
你可能没听过 “类器官” 这个词,但它极有可能成为未来医疗的 “救命神器”, 用干细胞培育出的 3D 微型器官,不仅长得和真实器官神似,还能精准复刻其功能。不管是测试新药是否有效、研究疾病发病机制,还是未来直接移植修复受损组织,类器官都被寄予厚望。
然而,这个 “微型器官模型” 长期以来卡在两个关键难题上:要么每次培养的形态、功能都不一样(可重复性差),要么只能小批量 “手工制作”(规模化不足),难以真正应用到临床和产业中。
 (DOI: 10.1038/s44385-025-00054-6)
(DOI: 10.1038/s44385-025-00054-6)
近日,韩国浦项科技大学(POSTECH)的 Dohui Kim、Dong Sung Kim 团队在顶级期刊《npj Biomedical Innovations》发表了一篇重磅综述报告,系统性梳理了类器官从 “实验室手工定制” 走向 “工业化量产” 的核心技术突破。这份报告不仅整合了全球最新研究成果,还提出了一套完整的类器官制造框架,为解决可重复性和规模化两大痛点提供了清晰路径,有望加速类器官从科研走向临床应用的进程。
什么是类器官?为什么它能改写医疗规则?
在了解技术突破前,我们先搞懂:类器官到底是什么 “黑科技”?简单说,类器官是用干细胞(比如人体诱导多能干细胞、成体干细胞)在实验室里培育出的 3D 多细胞结构。它不是完整的器官,但能精准复刻真实器官的关键结构和功能, 比如肠道类器官有类似肠道的绒毛和隐窝结构,肝脏类器官能像真实肝脏一样分泌白蛋白、代谢药物。相比传统的 2D 细胞培养和动物实验,类器官的优势堪称 “降维打击”:
更贴近人体:动物模型和人体生理差异大,很多药物在动物身上有效,在人身上却无效;而类器官直接源于人体细胞,能真实反映人体反应。
个性化定制:用患者自身干细胞培育的类器官,能精准模拟患者的疾病特征,实现 “一人一药” 的精准医疗。
伦理无负担:无需依赖人体器官捐赠或动物实验,避免了伦理争议。
正因为这些优势,类器官已被美国 FDA、欧盟监管机构和韩国食品药品安全部认定为 “极具潜力的临床前模型”,全球各大药企也纷纷将其纳入药物研发管线。但正如前面所说,可重复性差和规模化不足这两大 “拦路虎”,一直阻碍着它的普及。传统类器官培养大多依赖动物来源的基质(比如 Matrigel),这种基质成分不明、批次差异大,就像用不同批次的面粉做面包,口感和形状很难一致;同时,传统培养靠人工操作,效率极低,一个 6 孔板最多只能培养几十个类器官,根本满足不了大规模药物筛选或临床移植的需求。
三大技术突破,让类器官实现 “标准化量产”
浦项科技大学的研究团队在报告中指出,类器官要实现 “工业化制造”,核心是解决 “可重复性” 和 “规模化” 两大问题。他们整合了全球最新技术,将解决方案归纳为三大方向,每一个都堪称 “革命性突破”。
突破一:定制化 “人造支架”,解决 “每次都不一样” 的难题
传统类器官培养依赖的动物基质,就像 “盲盒”,成分不明、硬度不均,导致类器官发育随机。而研究团队提出的 “合成水凝胶”,相当于为类器官打造了 “定制化人造支架”,彻底解决了批次差异问题。这些合成水凝胶(比如 PEG、PIC、PAAm、PVA)是完全人工合成的,成分明确、硬度可调,还能根据不同类器官的需求 “量身定制”。比如培养肠道类器官时,科学家可以设计一种 “动态支架”:前期用较硬的材质帮助干细胞增殖,后期自动变软,引导干细胞分化成肠道特有的绒毛结构。实验显示,这种支架培育的肠道类器官,连续三次实验都能长出相似的形态,关键功能标志物表达一致。其中,PEG 水凝胶因商业化程度高、可塑性强,已广泛应用于肠道、肝脏、神经等多种类器官培养;而 PIC 水凝胶的 “温敏特性” 更具优势,低于 15℃是液体,高于 15℃自动成胶,温和包裹细胞不造成损伤,特别适合乳腺、肝脏类器官的长期培养。
突破二:空间调控 “精准导航”,让类器官长得 “有模有样”
如果说合成水凝胶是 “肥沃的土壤”,那么空间调控策略就是 “种植模具”,能引导类器官按预设形态发育,避免 “长得乱七八糟”。研究团队总结了四种核心空间调控技术:
外部限制:用微孔阵列、微胶囊等物理边界,控制类器官的大小和形状。比如在 PEG 微孔阵列中培养肾脏类器官,能让每个类器官的尺寸变异系数低于 10%,远优于传统培养的 30% 以上。
内部支架:在类器官内部植入微纤维网格,引导组织定向生长。比如在大脑类器官中加入微纤维支架,能让其形成更接近真实大脑的腔室结构,神经元连接更紧密。
基质力学调控:通过光照等方式局部改变支架硬度,引导类器官 “按需分化”。比如在肠道类器官培养中,用光照软化特定区域,能诱导形成肠道特有的隐窝结构。
可编程细胞组装:精准控制不同类型细胞的比例和位置,提前 “规划” 类器官的结构。比如用 DNA 标记技术,将肾祖细胞和输尿管芽细胞按特定比例组装,能高效培育出功能完整的肾脏类器官。
突破三:高产平台 + 自动化,实现类器官 “工厂量产”
解决了 “长得一致” 的问题,下一步就是 “批量生产”。研究团队提出的 “高产平台 + 自动化系统”,让类器官从 “手工作坊” 走进了 “现代化工厂”。
高产平台:一次能产上万个体器官
微孔阵列:在一个 6 孔板上制作上千个微型凹槽,每个凹槽都能培育一个类器官,一次可生产 1000 个以上肾脏类器官,是传统方法的 10 倍以上。
微流控液滴系统:通过微芯片将细胞封装在微小液滴中,每秒能生成一个类器官前体,10 分钟就能生产 100-1000 个,还能连续运行 8-10 小时。
悬浮生物反应器:通过动态搅拌让细胞在液体中悬浮生长,能处理从几百毫升到几升的培养体积,一次批次可生产 1-10 万个类器官,满足工业级需求。
自动化系统:全程无需人工干预
培养自动化:机器人负责细胞接种、培养基更换、药物添加等流程,还能实时监测类器官生长状态,避免人工操作带来的误差。比如肠道类器官培养,机器人能自动完成 6 天的扩增和 3 天的药物测试,全程无需人工插手。
操作自动化:通过 “拾取 - 流动 - 滴落” 等技术,自动分选、转移类器官,避免人工操作对类器官的损伤。比如用磁导航技术,能温和地将类器官转移到移植部位,存活率提升 30% 以上。
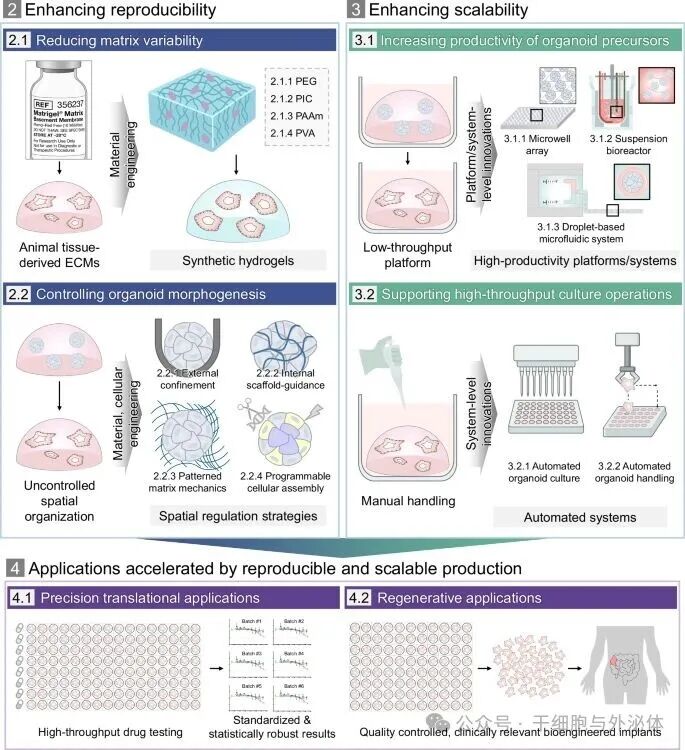 图:类器官应用领域的示意图。
图:类器官应用领域的示意图。
类器官实现 “标准化量产” 后,带来的不仅是科研效率的提升,更会彻底改变医疗、制药等多个领域的格局。
精准医疗:用药不用 “试错”,疾病早诊早治
对于癌症患者来说,未来只需取一小块肿瘤组织,一周内就能培育出上百个肿瘤类器官,同时测试多种药物的疗效,快速找到最适合患者的治疗方案,避免 “无效治疗” 和 “药物副作用”。在神经退行性疾病(如阿尔茨海默病)研究中,量产的大脑类器官能帮助科学家快速筛选潜在药物,原本需要几年的筛选过程,可能缩短到几个月。此外,类器官还能模拟罕见病的发病过程,为无药可治的罕见病提供新的治疗靶点。
再生医学:器官移植不再等待捐献
未来,用患者自身干细胞培育的肝脏、肾脏类器官,可能直接用于修复受损组织。比如肝硬化患者,无需等待肝移植,只需移植量产的肝脏类器官,就能修复肝功能;糖尿病患者也可能通过移植胰腺类器官,摆脱胰岛素依赖。研究团队在报告中提到,他们已用 PEG 水凝胶培育出功能完整的肝脏类器官,能分泌白蛋白、代谢尿素,且不含动物成分,符合临床移植标准。此外,通过 “血管化技术”,让类器官长出血管,能解决移植后的营养供应问题,为大规模组织修复奠定基础。
药物研发:告别 “动物实验”,研发成本大降
传统药物研发中,动物实验的成功率不到 10%,很多在动物身上有效的药物,在人体中却无效。而量产的类器官能精准模拟人体器官反应,大幅提高药物研发的成功率,同时避免动物实验的伦理争议。据估算,用类器官进行药物筛选,能将研发周期缩短 30%,成本降低 50%。未来,我们可能会看到更多高效、安全的新药更快上市,惠及更多患者。
未来已来:类器官量产的下一个风口
浦项科技大学的研究团队在报告中指出,类器官制造技术的下一个突破点,将是 “AI + 类器官” 的深度融合。未来,AI 能实时监测类器官的生长状态,自动调整培养条件,甚至预测类器官的功能表现,让生产过程更智能、更高效。此外,“类器官组装体”也将成为研究热点,将不同类型的类器官(如肠道类器官 + 免疫细胞类器官)组装在一起,能更真实地模拟人体器官间的相互作用,为复杂疾病研究提供更精准的模型。当然,类器官量产还面临一些挑战,比如如何进一步降低成本、建立统一的质量标准、解决长期保存问题等。但随着技术的不断进步,这些问题都将逐步解决。从 “手工定制” 到 “工厂量产”,类器官制造技术的革命,正在悄悄改变我们对医疗的认知。未来,看病不再是 “一刀切” 的治疗方案,而是 “量身定制” 的精准医疗;器官移植不再依赖 “等待捐赠”,而是 “按需培育” 的再生修复。这场由韩国浦项科技大学等科研团队引领的医疗革命,不仅让 “个性化医疗” 从口号变成现实,更让我们看到了人类攻克疑难杂症、延长健康寿命的无限可能。相信在不久的将来,类器官将走进更多医院、更多实验室,成为守护我们健康的 “微型卫士”。