
再生医学浪潮翻涌,多能干细胞疗法凭借其巨大的应用潜力与不断涌现的突破性成果,正跃升为全球医疗领域最炙手可热的赛道。
近来,这一前沿领域接连传来振奋人心的进展 —— 它们不仅为诸多难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
01 构建了内分泌细胞类型完备的胰岛
多能干细胞衍生的胰岛(PSC胰岛)移植含有功能性胰岛素分泌β细胞,是恢复糖尿病血糖控制的有前景的细胞疗法。
2025年8月8日,北京大学邓宏魁团队在Cell Stem Cell(IF=20.4)在线发表研究论文,该研究首次利用人多能干细胞成功分化构建了内分泌细胞类型完备的胰岛。这些胰岛能够高效响应血糖浓度变化,不仅能够有效降低血糖,更具备关键的升血糖功能,在糖尿病小鼠模型中展现出有效的低血糖防护能力,解决了干细胞来源的胰岛细胞类型及功能不全面的难题。

本研究中,团队通过表观小分子调控乙酰转移酶(HAT)P300/CBP活性,创新性地建立了非β内分泌细胞的高效诱导方案,结合重聚集技术成功构建了包含全部5种内分泌亚型的“重建胰岛”,通过调控重建胰岛中5种内分泌细胞的配比,解决了多能干细胞分化胰岛细胞类型缺失、胰岛功能不完善的问题。值得一提的是,β细胞和非β细胞分别产生于独立的“胰岛芽”,再整合成功能性胰岛的策略,与人胰岛自然发育过程相似,揭示了功能性内分泌细胞分化的规律。
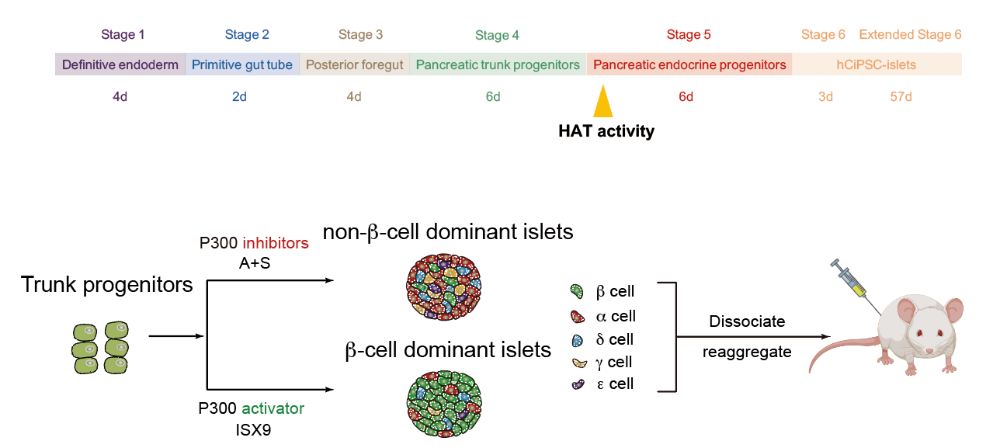
体外构建内分泌亚型完备的重建胰岛,评估胰岛内分泌组成对血糖调控的影响
团队利用1型糖尿病小鼠模型验证了重建胰岛的功能,并取得三项重要发现:1. 首次阐明胰岛细胞组成与血糖水平的定量关系,证实优化组成的重建胰岛更好维持生理性血糖水平;2. 揭示非β细胞(特别是α和δ细胞)的低血糖防护功能,在胰岛素过量或禁食条件下能有效避免低血糖发生;3. 通过高胰岛素-低血糖钳夹实验证实,重建胰岛可恢复机体的低血糖反向调节反应,包括更显著的C肽分泌“刹车”、胰高血糖素分泌激活和反向调节激素(如肾上腺素)的协同响应。
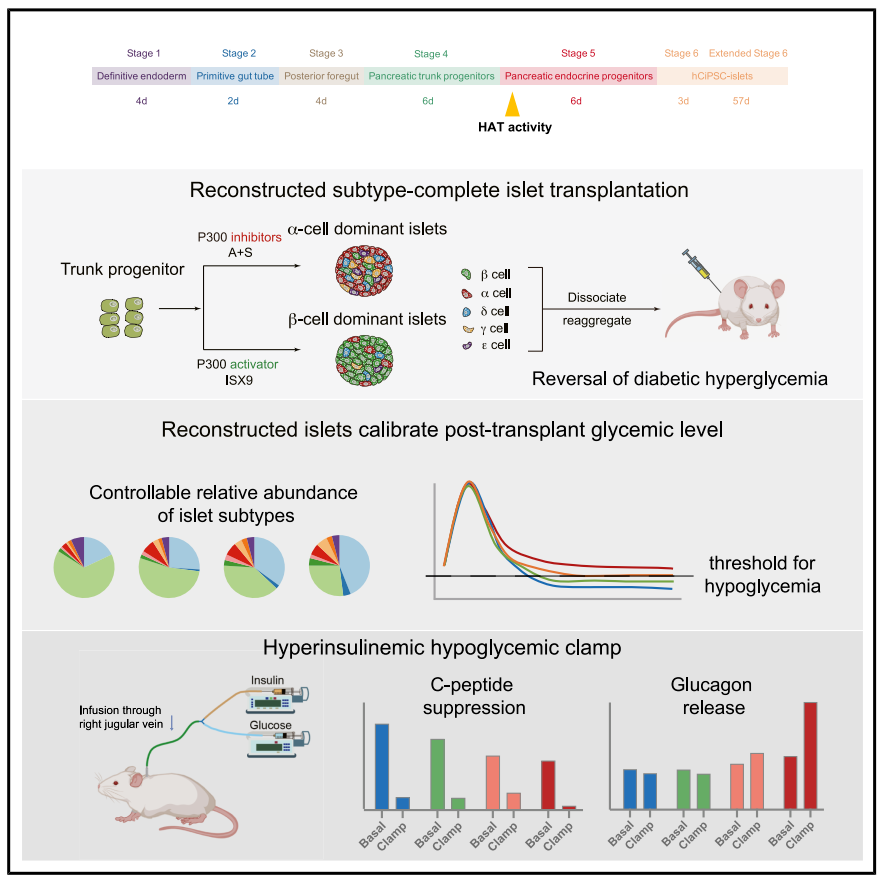
整合非β细胞的重建胰岛能有效避免低血糖,恢复机体的低血糖反向调节反应
该研究提出了一种在功能上概括双向血糖调节的真实胰岛的策略,并证明通过优化PSC胰岛中的内分泌细胞组成可以增强降血糖保护。这一进展为干细胞来源胰岛的临床转化提供了进一步的安全保障,有助于加速糖尿病细胞治疗的临床应用进程。
02 后原肠期胚胎整体模型
在胚胎发育研究领域,获取可模拟哺乳动物关键器官形成时期的实验模型一直是一个巨大挑战。
近期,来自剑桥大学干细胞研究所的Oytun Yilmaz团队在Cell Stem Cell杂志发表了最新成果,展示了一种完全不依赖转基因改造、仅利用小鼠原始型胚胎干细胞(naïve ESCs)和诱导多能干细胞(iPSCs)即可生成的后原肠期胚胎整体模型。
该方法能在体外重现包括神经管形成、体轴延长及早期器官发生等发育过程,为解析早期哺乳动物胚胎发生机制提供了强有力的新工具。

该研究的总体思路为:先获取小鼠naïve ESCs和iPSCs,在特定培养体系中维持其原始型状态;接着将这些细胞在低黏附微孔中聚集形成细胞团,通过自组织形成类似囊胚的前体结构;随后在精确调配的Wnt、BMP、FGF等信号分子调节因子条件下,诱导其进入后原肠期发育轨迹;最后利用活细胞成像和免疫荧光标记追踪形态变化,直至形成具备神经板、体节及原始肠管的整体模型。
该体系的最大优势在于简化与还原:它证明了在没有外源基因和额外细胞类型的情况下,原始型多能干细胞就能自发进入高度组织化的后原肠期发育,这不仅有助于解析细胞内在发育程序,也为疾病建模、突变功能验证及再生医学提供了标准化平台。
然而,该模型也存在一定局限性:由于缺乏胎盘及卵黄囊等胚外组织支持,其继续发育到更晚期受到限制;同时,尽管模型的形态与分子标志接近天然胚胎,但生理功能是否完全等效仍需进一步验证,且模型在不同细胞系之间的稳定性与可重复性也有待大规模评估。
这些突破性进展持续推动多能干细胞疗法在再生医学领域的深入探索,让其在难治性疾病治疗与生命科学基础研究中的价值不断凸显,也为未来医疗技术的革新与突破注入了源源不断的动力。