
在医学科技日新月异的当下,多能干细胞疗法凭借其磅礴的潜力与层出不穷的突破性成果,已然成为全球医疗领域聚焦的核心。
近来,这一前沿领域接连传来振奋人心的进展 —— 它们不仅为诸多难治性疾病的治疗开辟了全新路径,更给整个再生医学的发展注入了强劲动能,让攻克疑难病症的希望愈发清晰。
01 HaloTag-PIEZO1
PIEZO1是一种机械门控离子通道,在感知血流、组织张力、细胞牵拉等生理机械刺激中发挥核心作用。然而,研究者一直缺乏一种既能定位内源PIEZO1,又能实时监测其通道活性的非侵入式工具。
近日,美国加州大学团队开发出一种新颖的HaloTag-PIEZO1人诱导多能干细胞(hiPSC)平台,成功在多个分化细胞类型及类器官中“动态可视化”了PIEZO1的空间定位与功能状态,为研究人类力感应通道机制和疾病建模提供了强有力的工具。

该核心价值在于:
1. 内源性&人源化:直接在人类基因组水平标记内源性PIEZO1,避免了过表达干扰,结果更具生理相关性。
2. 多功能性:HaloTag兼容多种配体,本研究聚焦成像(定位与活性),但其潜力远不止于此(如蛋白互作研究、高效纯化、靶向降解Protacs)。
3. 高性能成像:JFHTLs的超高亮度、超强抗光漂白性使定位成像的精度、持续时间和信噪比远超传统荧光蛋白(如tdTomato),首次清晰揭示了PIEZO1的异质性扩散模式和迁移细胞中的动态富集。
4. 单通道活性监测革命:Ca²⁺敏感的JF646-BAPTAHTL结合HaloTag的定位优势,首次在完整细胞和组织中实现了对内源性PIEZO1接近膜片钳时间分辨率(~4ms)的单通道活性非侵入式光学记录,并能同时追踪移动通道的活性。
5. 多尺度能力:平台可分化多种细胞类型(ECs,NSCs,角质形成细胞)和复杂三维类器官(MNRs)。特别是利用光片显微镜,成功实现了对活体人源类器官中PIEZO1的分子尺度定位和活性在三维组织环境中的可视化,揭示了其空间分布和激活的组织力学基础。
6. 揭示新生物学:发现不同人类细胞类型(NSCsvs.ECs)中PIEZO1活性的固有差异,以及在神经类器官中PIEZO1在管腔富集但外缘激活效率更高的空间特异性调控模式。
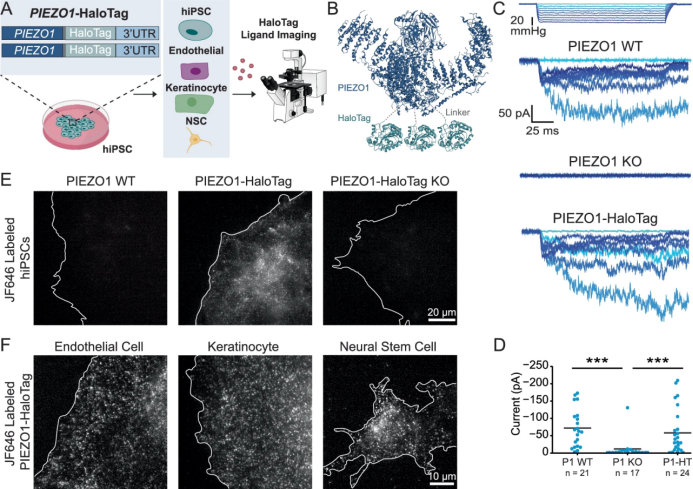
PIEZO1-HaloTag hiPSC系的生成和验证
该研究通过巧妙的基因工程(内源性PIEZO1-HaloTag hiPSC)、创新的化学探针(高性能JF HTL,特别是Ca²⁺敏感的JF646-BAPTA)和尖端的成像技术(TIRF、超分辨追踪、尤其是光片显微镜AO-LLSM),建立了一个强大的集成平台。它不仅克服了现有技术的诸多局限,更首次在人类生理相关的模型系统(从单细胞到三维类器官)中,实现了对内源性PIEZO1的高精度定位、动态追踪和超高时间分辨率的单通道活性监测。这项工作是机械敏感性离子通道研究领域的重大突破,将极大推动我们对PIEZO1在人类健康和疾病中复杂作用的理解,并为未来治疗干预策略的开发奠定坚实基础。
02 高通量机器人分离技术
近日,日本东京都医学科学研究所的Takahashi团队在Stem Cell Research & Therapy期刊发表了一项突破性研究。他们开发出一种高通量机器人分离技术,首次系统揭示了CRISPR-Cas9在人类iPS细胞中诱导纯合基因突变的高频现象,为基因编辑在再生医学中的精准应用奠定了重要基础。
研究团队设计了一种三维培养体系,将单个iPS细胞包裹在Matrigel(基质胶)形成的 “穹顶” 中,为细胞提供类似体内微环境的支撑结构。同时,引入CELL HANDLER机器人系统,利用其视觉识别系统,通过直径、圆形度等参数精准筛选单克隆来源的细胞团,能够识别并分离直径仅100-200微米的细胞团块。
通过对1000多个基因编辑后的iPS细胞克隆进行深度分析,团队发现纯合编辑突变的频率远高于杂合突变,首次实现了单细胞水平的系统 profiling,为理解基因编辑的随机性与规律性提供了关键数据。
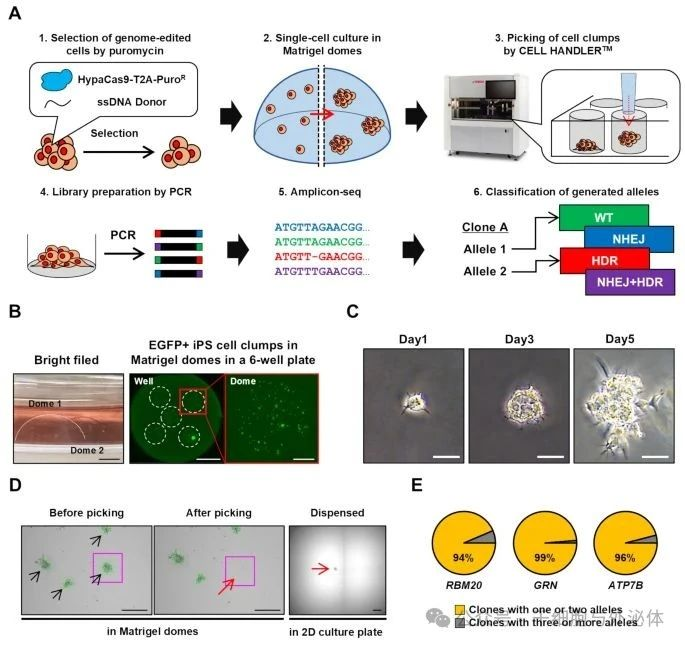
基因组编辑的人iPS细胞克隆的机器人分离
该研究成果为基因编辑在再生医学中的精准应用奠定了重要基础,有助于推动基因编辑技术在疾病治疗等方面的发展,为实现个性化细胞治疗等目标迈出了重要一步。
03 iPSC-类器官
近日,加州大学洛杉矶分校(UCLA)的研究团队利用诱导多能干细胞(iPSCs),成功培育出具有完整血管网络的肺部和肠道类器官。这些微型器官不仅在结构上与真实器官高度相似,还具备相应的生理功能,为疾病研究、药物测试及个性化治疗提供了强大的新工具。
该研究中,研究团队通过精确调控骨形态发生蛋白(BMP)信号通路,在三维胚胎体中同时分化中胚层和内胚层细胞,实现了肺部和肠道类器官的血管化。这种创新方法不仅优化了类器官的细胞类型多样性、三维结构和成熟度,还显著提高了细胞存活率。实验中,他们发现,通过调整BMP信号的时序和强度,能够在早期阶段平衡中胚层和内胚层的比例,从而影响类器官的前后轴(A-P)模式形成,为后续的组织特化奠定基础。
研究团队将这一技术应用于一种名为肺泡毛细血管发育不良伴肺静脉错位(ACDMPV)的罕见先天性疾病。这种疾病由FOXF1基因突变引起,导致肺部血管发育异常,目前尚无有效治疗方法。
通过从患者干细胞中培育出血管化肺类器官,研究人员首次成功再现了疾病的血管缺陷和继发性上皮异常。这一突破性成果不仅验证了新模型在疾病研究中的潜力,还为揭示细胞间相互作用在疾病发生中的作用提供了新视角。
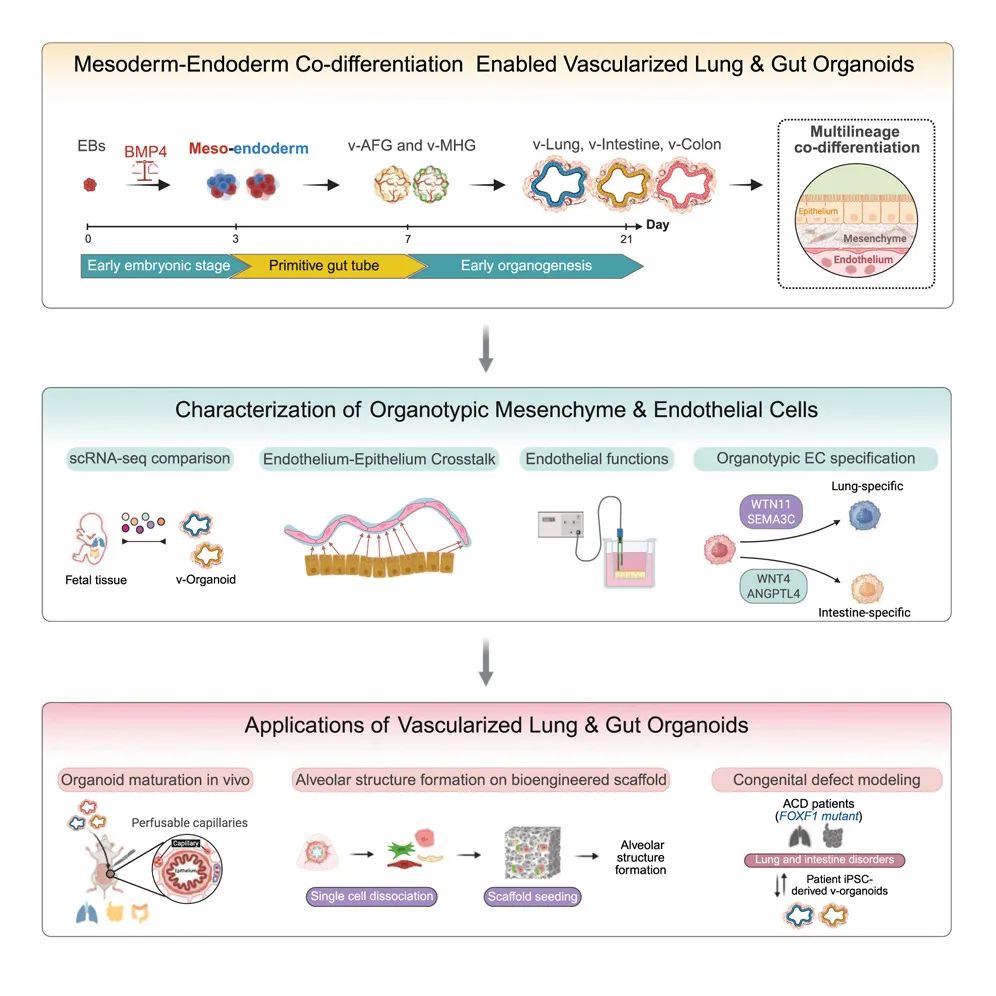
图形摘要
这一研究不仅为肺部和肠道疾病的机制研究提供了新的视角,还为个性化医疗和再生医学开辟了新的路径。未来,这些血管化类器官有望与微流控芯片技术结合,用于研究免疫细胞与内皮细胞的动态相互作用,甚至探索移植排斥反应的机制。
研究团队强调,尽管目前的类器官模型尚未完全成熟,但通过进一步优化培养条件,如引入氧气梯度和机械刺激,有望实现更接近成人器官的功能特性。这一技术的广泛应用将为器官芯片和人体模型系统的研究注入新的活力。
上述三项研究从不同维度推动了多能干细胞疗法及相关领域的发展,共同彰显了多能干细胞技术在探索生命机制、攻克疑难疾病及推动再生医学进步中的巨大潜力,也为未来医疗领域的创新发展开辟了更广阔的空间。