
近年来,诱导多能干细胞(iPSC)技术发展正深刻改变着我们探索大脑奥秘的方式 。研究者们不再仅仅依赖动物模型或有限的患者样本,而是能够利用iPSC在培养皿中构建出人类神经细胞,甚至是微型的“类脑”结构,为理解神经系统疾病和开发新疗法打开了前所未有的大门 。从最初简单的二维细胞片层,到如今能够模拟大脑复杂结构和功能的三维神经球与类脑器官,iPSC神经模型的发展日新月异 。
近期,多篇研究再次刷新了我们对iPSC潜能的认知,将神经模型的构建与应用推向了新的高度。本文将聚焦其中三项代表性成果,首先是来自美国宾夕法尼亚州立大学医学院的Rhea Sullivan及其团队发表于PLoS One的研究,他们利用iPSC构建了中脑神经干细胞模型,以探究产前阿片类药物暴露对大脑发育的深远影响。紧接着,比利时安特卫普大学的Sarah De Beuckeleer团队在eLife上展示了其创新成果,他们开发出一种基于人工智能的图像分析方法,能够精准识别复杂神经培养物中的不同细胞类型,极大地提升了研究的精确性和效率。最后,美国国家神经疾病与卒中研究所的Tongguang Wang团队在JoVE上发表了他们构建含小胶质细胞的人脑类器官的新方案,为研究大脑中的免疫反应与神经炎症提供了更逼真的平台。上述研究反映出iPSC技术在神经科学领域激动人心的发展前景,预示着我们离攻克神经系统顽疾的目标又近了一步。
研究亮点
1.iPSC模型首次精细模拟产前阿片类药物暴露与戒断对人中脑神经祖细胞命运的具体影响,揭示了药物干预发育的潜在机制 。
2. AI赋能细胞识别,其开发的CNN工具能高精度、无偏倚地解析复杂iPSC衍生神经培养物组分,提升模型质控与分析效率 。
3. 成功构建了含内源性发育小胶质细胞的人脑类器官,为研究早期神经-免疫相互作用及相关疾病提供了更逼真的平台 。




内容介绍
01 模拟“孕期风险”:iPSC揭示阿片药物对发育大脑的影响
产前阿片类药物暴露对新生儿神经发育的潜在危害已成为一个日益受到关注的公共卫生问题。为了在细胞层面探究这一问题,来自宾夕法尼亚州立大学医学院的Sullivan R.团队巧妙地利用iPSC技术,构建了人源中脑神经祖细胞模型 。他们首先将健康人iPSC分化为中脑区域的神经祖细胞,这些细胞是未来大脑中关键神经元(如多巴胺神经元)的“种子”。
研究团队精心优化了分化方案,确保这些祖细胞能充分表达阿片类药物的关键受体,从而更真实地模拟药物作用的靶点 。随后,他们让这些细胞在培养皿中经历慢性吗啡暴露,并模拟了药物戒断的过程。通过一系列精密的细胞和分子生物学检测,他们发现,与对照组和单纯吗啡暴露组相比,经历吗啡戒断的神经祖细胞表现出环磷酸腺苷(cAMP)水平的显著“超射”——这是一种在成熟神经元阿片戒断中常见的生化信号改变,提示了早期发育阶段神经细胞对药物戒断的敏感性 。
更重要的是,研究揭示了药物暴露与戒断对细胞命运的深远影响。慢性吗啡暴露似乎“卡住”了神经祖细胞的发育进程,使得更多细胞停留在未成熟的祖细胞状态(巢蛋白nestin阳性细胞比例增加),而分化成熟的神经元(NeuN阳性细胞比例减少)则相应减少 。然而,当吗啡被撤去(模拟戒断)后,情况发生了逆转:星形胶质细胞(GFAP阳性细胞,大脑中的重要支持细胞)的比例下降,而神经元的比例则显著增加,甚至超过了正常水平 。这一发现提示,产前阿片类药物的暴露与戒断可能会扰乱神经元和胶质细胞产生的微妙平衡,对大脑的早期构建产生潜在的长期影响。尽管该研究未观察到细胞增殖和总体活力的显著变化,但其建立的体外模型为深入研究阿片类药物如何影响早期神经发育中的细胞命运决定提供了宝贵的工具,也为未来探索干预策略奠定了基础(图1)。
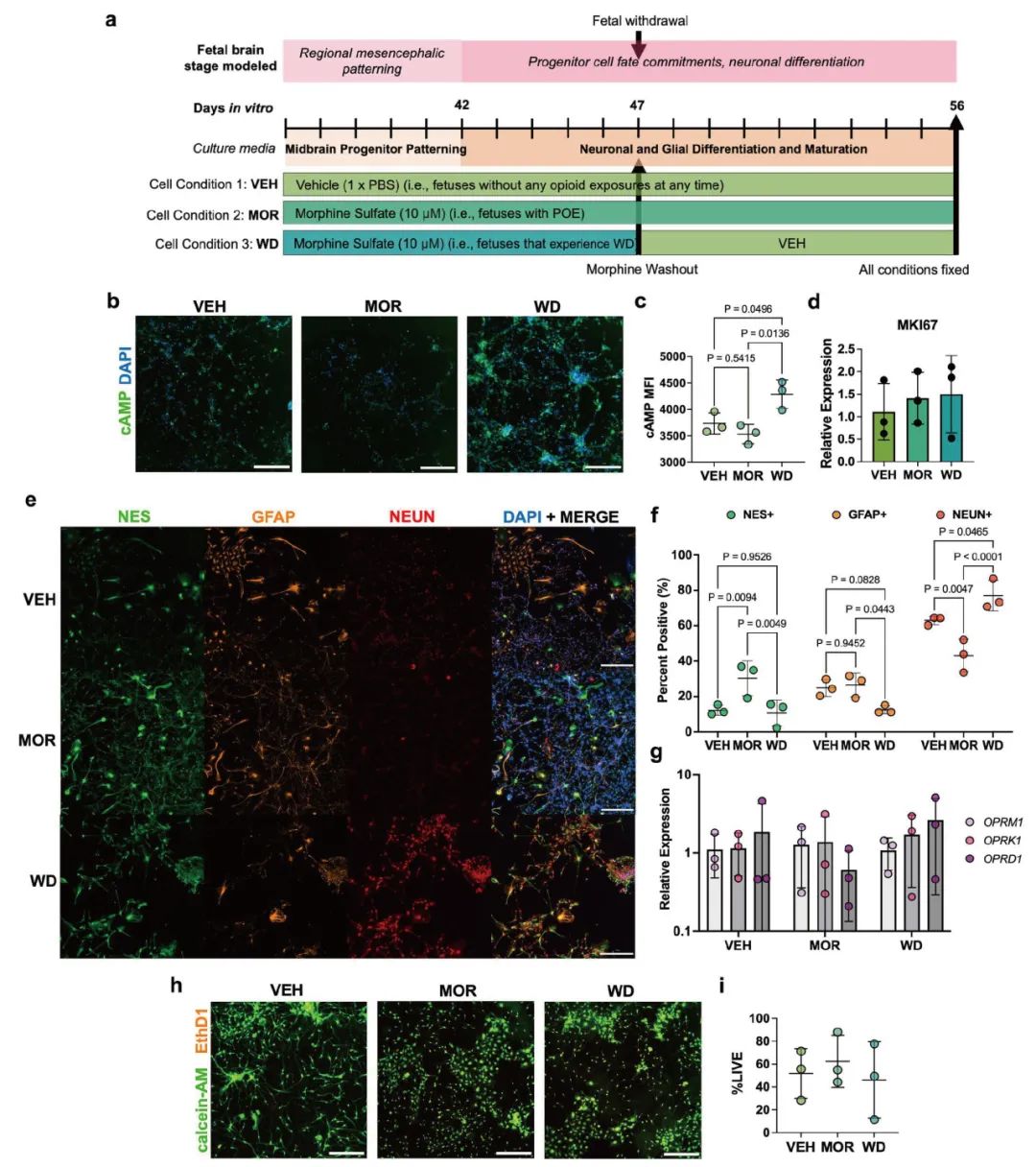
图1.慢性吗啡暴露和戒断改变了谱系特异性中脑祖细胞最终分化的比例。(a) 采用较长神经诱导和模式化方法获得的中脑神经祖细胞进行慢性吗啡暴露和戒断处理的实验流程。(b) 分化中的神经祖细胞在吗啡戒断24小时后固定并进行细胞内cAMP免疫染色 (n=3)。比例尺为300 μm。(c) 使用Biotek Cytation 5对不同条件下cAMP的平均荧光强度值进行量化。与载体组(VEH)和吗啡暴露组(MOR)相比,戒断组(WD)细胞的cAMP平均荧光强度显著更高 (单因素方差分析,Tukey多重比较,F = 9.411, p = 0.014)。(d) 不同条件下增殖标记物Ki67的相对表达量没有差异 (单因素方差分析,F = 0.2614, p = 0.7783)。(e) 在第56天,对分化细胞进行固定,并用细胞身份标记物NES(绿色)、GFAP(橙色)和NEUN(红色)进行免疫染色。所有图像均在10倍镜下拍摄。比例尺为300 μm。(f) 通过使用Biotek Cytation 5对每个DAPI+细胞的平均染色强度进行阈值设定来确定细胞身份。通过将NES+、GFAP+或NEUN+细胞的总数除以DAPI+细胞的总数来确定比例。在不同处理条件和细胞标记物对分化细胞命运比例的影响上存在统计学上显著的交互作用 (双因素方差分析,F(4,18) = 16.05, p < 0.0001)。(g) 慢性吗啡暴露和戒断并未导致经典阿片受体转录水平发生变化 (双因素方差分析,F(4,18) = 0.569, p = 0.688)。(h) 在吗啡戒断24小时后,对活的、未固定的细胞进行LIVE/DEAD™染色。比例尺为300 μm。(i) 不同处理条件下钙黄绿素-AM (calcein-AM)+ 细胞的比例没有差异 (单因素方差分析,F = 0.292, p = 0.756)。
02 AI慧眼识细胞:智能解析复杂神经培养物
随着iPSC衍生神经模型变得越来越复杂,例如包含多种神经细胞类型的混合培养物或三维类器官,如何准确、高效地识别和量化其中的不同细胞成分,成为了一个巨大的挑战。传统的手动计数或基于特定标记物的分析方法不仅耗时耗力,有时还难以应对细胞密度高、形态异质性大的复杂情况。针对这一难题,安特卫普大学的De Beuckeleer S.团队开发出一种基于人工智能(AI)的创新解决方案 。
他们的核心技术是一种结合了“细胞绘制”(cell painting,一种多通道荧光成像技术)和卷积神经网络(CNNs)的图像分析方法。研究人员首先使用多种荧光染料对培养的神经细胞进行染色,捕捉细胞的形态、纹理以及关键蛋白的表达信息。然后,他们训练CNN模型来学习和识别不同细胞类型的独特“指纹”。令人印象深刻的是,这种AI方法在区分神经母细胞瘤和星形细胞瘤细胞系时,准确率超过了96%,显著优于传统的基于形态纹理特征的随机森林分类方法。该团队还提出了一种巧妙的“核中心”(nucleocentric)分析策略。在细胞非常密集的培养物中,完整地分割出单个细胞的轮廓非常困难。而“核中心”方法则将分析重点放在细胞核及其紧邻的周边区域,利用这部分相对容易识别且信息丰富的区域特征来进行细胞类型的判断,从而在高密度培养条件下依然保持了高准确性 。
更具实际意义的是,该方法成功应用于iPSC衍生的真实神经培养物。它不仅能够准确评估培养物的成熟状态(区分神经元与祖细胞的准确率高达96%),还能在包含神经元、星形胶质细胞和小胶质细胞的复杂混合培养物中,精确区分出不同类型的细胞,甚至能够识别出小胶质细胞的不同激活状态。这项技术的突破,为iPSC神经模型的质量控制、成分分析以及高通量药物筛选提供了强有力的自动化工具,有望极大提升研究的可重复性和细胞类型特异性,加速神经科学领域的研究进程(图2)。
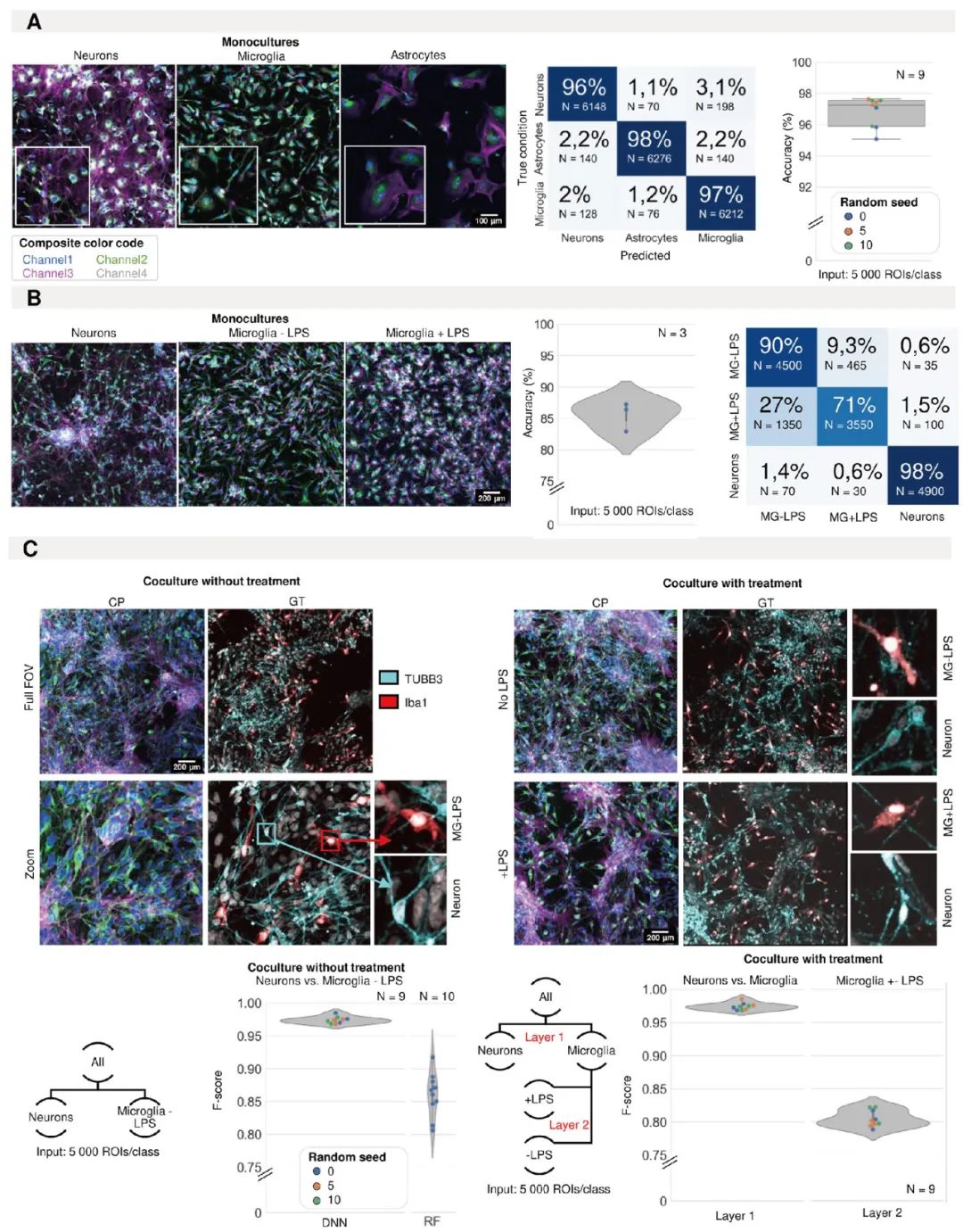
图2.利用形态学分析鉴定诱导多能干细胞 (iPSC) 细胞类型。(A) iPSC衍生的神经元、星形胶质细胞和小胶质细胞在单培养中进行形态学染色的代表性图像。卷积神经网络 (CNN) 对iPSC衍生的星形胶质细胞、小胶质细胞和神经元的单培养物进行分类的预测准确性和混淆矩阵(所有模型的平均值)。箱线图中的每个点代表一个分类器(模型初始化,N=9)的F1分数。分类器使用三种不同的随机种子训练3次。(B) 经LPS或对照处理的iPSC衍生的神经元和小胶质细胞单培养物的代表性图像(颜色代码定义见图1A)。给出了预测准确性和混淆矩阵(所有模型的平均值)。小提琴图中的每个点代表一个分类器(模型初始化,N=3)的F1分数。(C) iPSC衍生的小胶质细胞和神经元混合培养的代表性图像。真实情况通过免疫荧光染色 (IF) 鉴定。小提琴图中的每个点代表一个分类器(模型初始化)的F1分数。分类器使用三种不同的随机种子进行训练。CNN的结果与浅层学习(随机森林,RF)进行比较。对经LPS处理或对照处理的神经元和小胶质细胞混合培养物进行了相同的分析。采用分层方法,首先将神经元与小胶质细胞分离,然后对处理过和未处理过的小胶质细胞进行分类。小提琴图中的每个点代表一个分类器(模型初始化,N=9)的F1分数。分类器使用三种不同的随机种子训练3次。
03 构建“迷你免疫脑”:iPSC类器官整合小胶质细胞
脑类器官,这些由iPSC在体外三维培养形成的“微型大脑”,为模拟人类大脑发育和疾病提供了前所未有的平台。然而,早期的大多数脑类器官模型都缺失了一个关键的细胞组分——小胶质细胞。小胶质细胞是大脑中常驻的免疫细胞,在神经炎症、神经感染以及大脑发育和稳态维持中扮演着至关重要的角色。如何在类器官中整合功能性的小胶质细胞,一直是该领域努力的方向。
美国国家神经疾病与卒中研究所的Wang T.团队在这一领域取得了重要进展,他们开发出一种可靠且可重复的方案,用于生成内源性发育小胶质细胞的人脑类器官。其核心策略是在iPSC分化形成胚状体(类器官的早期雏形)的阶段,就将iPSC衍生的造血祖细胞(HPCs,小胶质细胞的前体细胞)整合进去。随后,这些共培养的胚状体在特定的神经诱导、增殖和成熟条件下,逐渐发育成包含神经元和小胶质细胞的三维脑类器官。
通过免疫染色(检测IBA1、TREM2等小胶质细胞特异性标记物)和单细胞RNA测序等先进技术,研究人员证实了这些类器官内确实存在着由共同引入的HPCs发育而来的小胶质细胞。更重要的是,这些整合的小胶质细胞并非“徒有其表”,它们具有正常的生理功能。当用脂多糖(LPS,一种能够模拟细菌感染并诱导炎症反应的物质)刺激这些类器官时,其中的小胶质细胞表现出典型的炎症反应,证明了其免疫活性。有趣的是,即使没有在培养基中添加所有已知促进小胶质细胞分化的特定细胞因子,HPCs也能够在类器官的神经环境中成功分化为小胶质细胞 。这表明,发育中的神经微环境自身就能产生足够的信号,引导小胶质细胞的特化和成熟,这使得该模型更接近于体内真实的大脑发育过程。这项工作不仅为研究先天免疫系统与发育中神经系统之间的早期相互作用提供了宝贵的工具,也为模拟涉及神经炎症或神经感染(如阿尔茨海默病、帕金森病、寨卡病毒感染等)的复杂疾病开辟了新的途径(图3-4)。
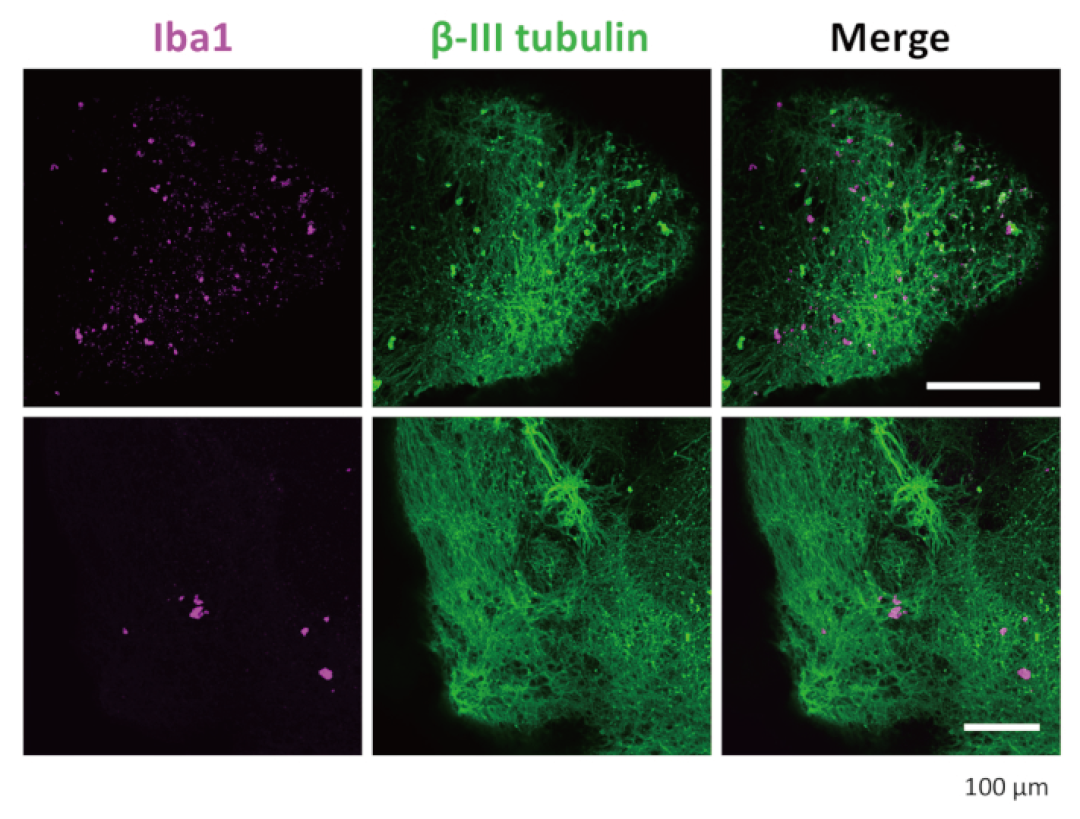
图3.3D类器官中神经元和小胶质细胞的免疫染色。经过透明化处理和免疫染色后,类器官显示小胶质细胞呈IBA1阳性染色,神经元呈βIII-微管蛋白阳性染色。显示的代表性图像是在共聚焦显微镜下使用20倍物镜拍摄的。
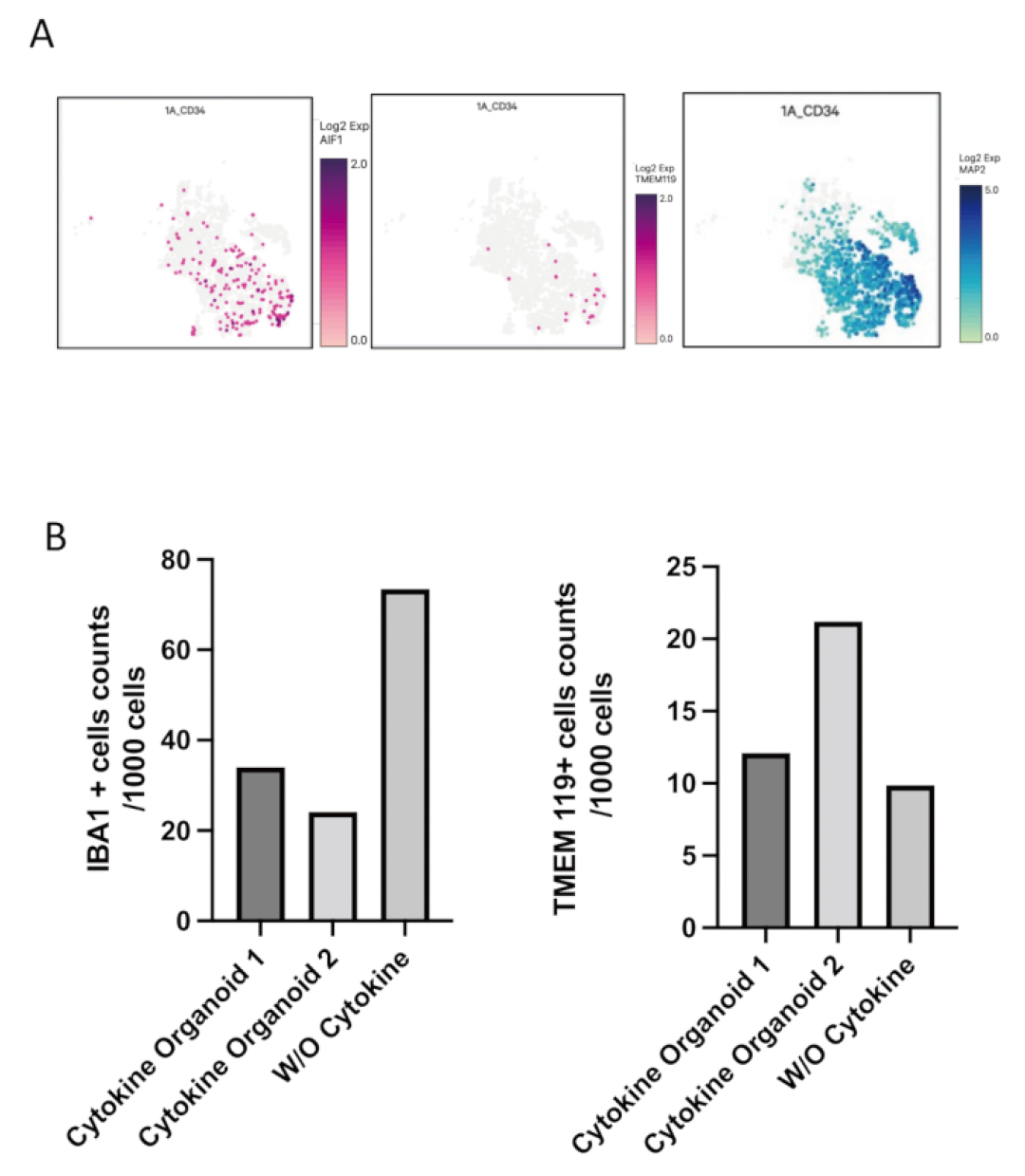
图4.含小胶质细胞的3D类器官的单细胞RNA测序结果。(A) 图表显示了在未添加额外小胶质细胞分化细胞因子的类器官中,IBA1(AIF1)、TMEM119和MAP2的分布。(B) 在两个用额外小胶质细胞分化细胞因子培养的类器官和一个未用其培养的类器官中,对IBA1和TMEM119阳性的小胶质细胞进行了计数。代表性类器官中IBA1和TMEM119阳性细胞的数量发生变化。
未来展望
未来,iPSC诱导的神经模型依然充满无限可能,并将在神经科学的多个领域持续发光发热。首先,在模型构建方向,科学家们将致力于提升分化细胞的“成熟度”,使其更接近成年人的生理状态,从而更准确地模拟晚发性神经退行性疾病 。同时,构建包含更多种类细胞(如血管细胞、更多类型的免疫细胞)的、结构更复杂、功能更完善的三维类脑器官,将是未来的重要攻关方向 。此外,建立标准化的iPSC神经细胞生产和鉴定流程,对于确保研究结果的可靠性、可重复性,以及满足大规模药物筛选和未来临床治疗对细胞数量和质量的需求至关重要。技术融合将是驱动未来发展的主旋律。AI和机器学习将在分析iPSC模型产生的海量复杂数据(如高内涵成像、多组学数据)以及优化细胞分化方案中扮演越来越重要的角色。
iPSC技术的发展也伴随着生产成本、潜在的免疫排斥风险(即使是自体细胞也可能在特定情况下发生)以及长期安全性和有效性等方面的挑战,但iPSC技术及其衍生的神经模型无疑为我们理解和攻克神经系统疾病带来了前所未有的光明前景。这些不断进化的“掌中大脑”,正以前所未有的深度和广度,助力科学家揭示大脑的奥秘。