
人类多能干细胞(hPSC)疗法在再生医学领域宛如一颗璀璨新星,自首次成功获取 hPSC 的 27 年来,其相关技术飞速发展,为众多疑难病症的治疗带来曙光。hPSC 涵盖人类胚胎干细胞(hESC)和人类诱导多能干细胞(hiPSC),前者能大量生产非癌性人类细胞为细胞治疗提供了充足的资源,后者则打破了传统细胞来源的桎梏,二者理论上都为再生医学提供了无限可能。

Pluripotent stem - cell-derived therapies in clinical trial: A 2025 update发表于Cell Stem Cell杂志,全面梳理和分析了截至 2024 年 12 月全球 hPSC 疗法的临床试验进展,为理解该领域的研究现状、面临的挑战及未来发展方向提供了重要参考。
早期试验
1998年
hESC 成功提取,使得人类能够生产非癌性人类细胞以及获取具有治疗意义的人类细胞类型,为再生细胞疗法奠定基础。
2007
2007 年,山中伸弥和俞君英分别在《细胞》和《科学》杂志上发表重要成果,报道了在体外培养条件下成功将人类皮肤细胞转化为 hiPSC 的重大研究。hiPSC 的出现,使得体细胞重编程成为可能,从而可以创建自体细胞系及 HLA 纯合供体细胞系,满足减少免疫抑制的需求。
2007 - 2012 年期间
随着培养系统改进,以色列、新加坡和英国陆续建立 GMP 条件下的 hESC 库。
2008年
Geron Corporation 成功获得美国食品药品监督管理局(FDA)批准 新药临床试验申请(IND),开展 hPSC 衍生产品I期临床试验——使用hESC衍生的少突胶质前体细胞产品(GRN-OPC1)治疗胸脊髓损伤。
2011 - 2015 年期间
这一阶段进入临床试验的 hPSC 产品均基于视网膜色素上皮细胞(RPE),用于治疗眼部疾病。Advanced Cell Technology 公司的 MA09 - hRPE 产品在此期间开展了5项试验。
2013 年
日本 RIKEN 研究所的 Masayo Takahashi 团队开发出首个自体 hiPSC 产品,并在日本进行治疗年龄相关性黄斑变性(AMD)的临床试验,但因制造复杂性和成本高未继续。
临床试验全景
截至 2024 年 12 月,全球范围内已有 115 项介入性临床试验获批,对83 种 hPSC 产品展开测试,涉及 34 种适应症,超过 1200 名患者接受了 hPSC 产品的治疗,累计使用细胞数量超 1011 个。
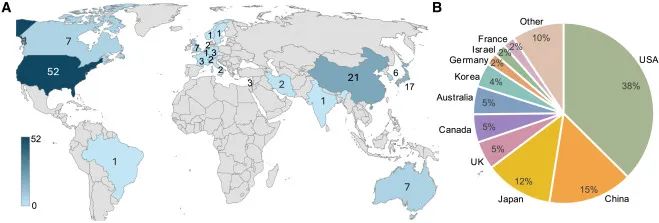
这些试验分布在全球各地,其中美国、日本和中国是研究的主要集中地,hPSC 临床试验的数量分别为52项、17项和21项。
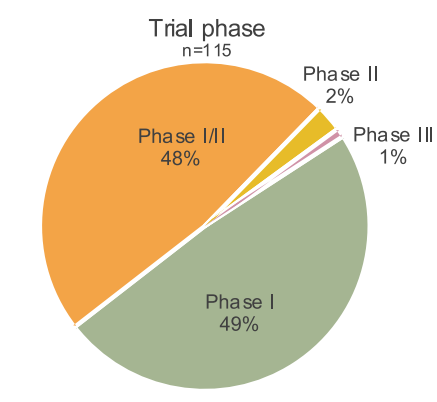
这些试验大多集中在 I 期和 I/II 期,主要聚焦于安全性和可行性的验证,仅有少数试验开始探索产品的有效性。
不同细胞来源
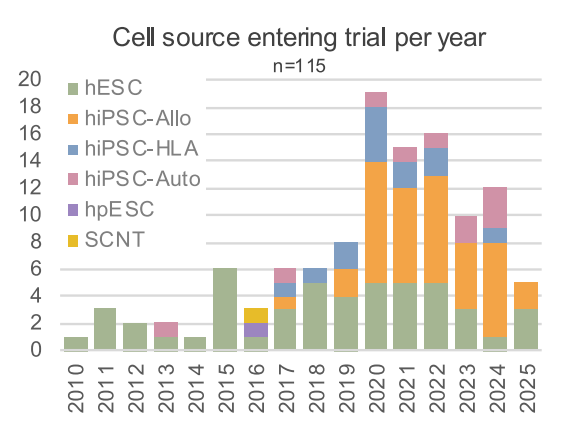
hESC:人类胚胎干细胞;hiPSC - Allo:异体人类诱导多能干细胞;hiPSC - HLA:与人类白细胞抗原匹配的诱导多能干细胞;hiPSC-Auto:自体人类诱导多能干细胞 ;hpESC:人类孤雌生殖胚胎干细胞;SCNT:体细胞核移植
2010年至2014年,试验主要使用 hESC。2013年至2019年,其他细胞来源如 hiPSC-Auto和 hiPSC-HLA逐渐兴起并增多,特别是 hiPSC-Auto 在某些年份增长显著。2020年至2024年,基于 hiPSC 的产品试验数量显著增加,hiPSC成为多能干细胞疗法研究的主要方向。
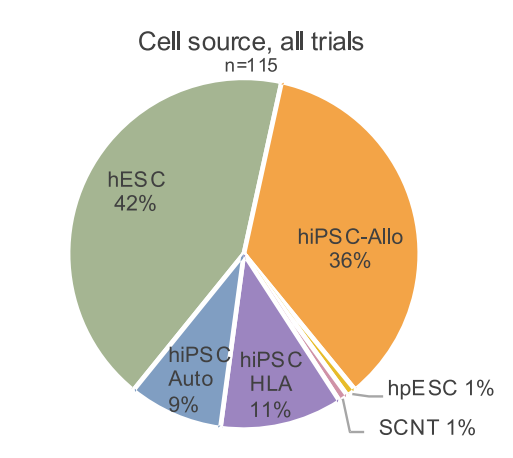
在所有试验的细胞来源中,hiPSC占比最大,达到56%,是最主要的细胞来源。其中 hiPSC - Allo占35%,hiPSC - Auto 占比13%,hiPSC - HLA 占比3%。其次为 hESC,占42%,hpESC 和 SCNT 各占1%。总体而言,显示出 hiPSC 具有广阔的应用前景。
不同领域产品
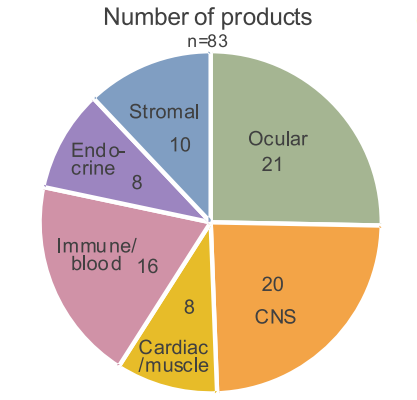
hPSC 产品类型主要为:眼部(Ocular,21种)、中枢神经系统(CNS,20种)、心脏 / 肌肉(Cardio/Muscle,8种)、免疫 / 血液(Immune/Blood,16种)、内分泌(Endocrine,8种)以及基质(Stromal,10种)。
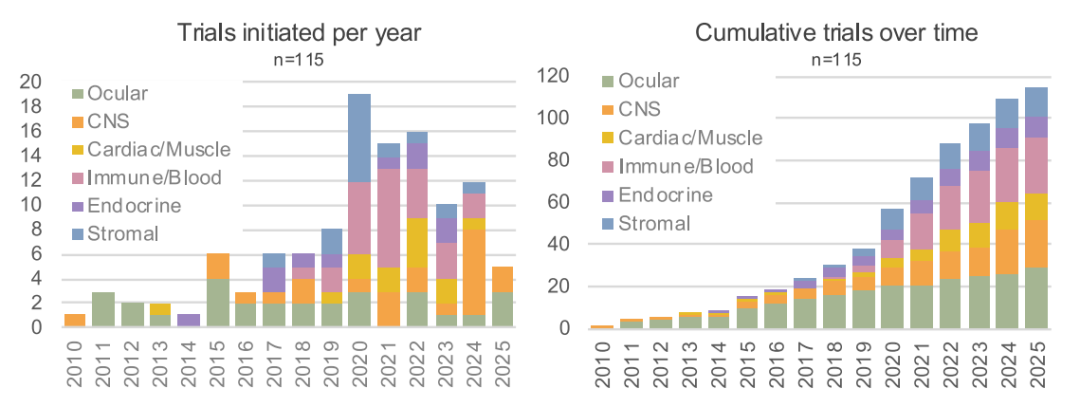
早期的 hPSC 试验主要集中在眼部和中枢神经系统领域,数量有限。2015年后,试验数量显著增加,产品类型也更加多样化,涵盖了免疫/血液、内分泌等多个领域。各类产品的累计试验数量均有所增长,其中眼部和中枢神经系统产品的试验增长尤为显著,早期发展迅速;而心脏/肌肉、免疫/血液、内分泌等类型的产品,尽管初期试验较少,但后期增长明显;基质类产品虽然累计试验数量相对较少,但也呈现出一定的增长趋势。
眼部疾病
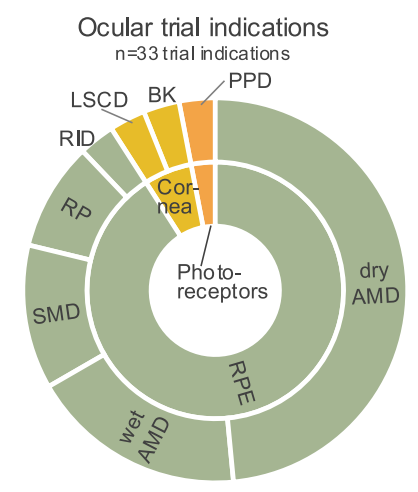
AMD:年龄相关性黄斑变性;SMD:斯塔加特黄斑变性;RP:视网膜色素变性;RID:视网膜色素上皮受损疾病;LSCD:角膜缘干细胞缺乏症;BK:大泡性角膜病变;PPD:原发性光感受器疾病;Cornea:角膜;Photoreceptors:光感受器细胞;RPE:视网膜色素上皮细胞
眼部疾病是最早开展hPSC衍生疗法临床试验的领域之一,主要针对RPE功能障碍和退行性疾病,如AMD和SMD。在眼部 hPSC 试验中,针对 AMD 的研究最为广泛。其他适应症如 SMD、RP等也有一定数量的试验,但占比相对较小。
干性 AMD 和 SMD
2011年,Advanced Cell Technology(后被Astellas收购)启动了首个hESC衍生的 RPE细胞悬浮液(MA09-hRPE)的临床试验,用于治疗 SMD 和干性 AMD。结果显示,部分患者视力有所改善,但总体效果有限。此后,多个团队继续探索 RPE 细胞片和悬浮液的不同形式,如 Regenerative Patch Technologies的 Cynata iPSC-MSC 治疗移植物抗宿主病和骨关节炎,以及 RIKEN 研究所的自体hiPSC-RPE 细胞片。
湿性 AMD
2013年,日本 RIKEN 研究所的Masayo Takahashi团队首次使用自体 hiPSC 衍生的RPE细胞片治疗湿性 AMD,显示出良好的移植存活率和视力稳定。此后,多个团队也开展了类似的研究,如Moorfields Eye Hospital的 hESC-RPE 细胞片和 Kobe City Eye Hospital 的 hiPSC-RPE 细胞悬浮液。
其他眼部适应症
2019年到2023年,法国 iSTEM、日本神户市立医院、日本大阪大学等分别开展针对RP、LSCD、BK 等疾病的临床试验,未出现严重不良事件,且疾病症状有所改善。BlueRock Therapeutics 公司使用 hiPSC 衍生的光感受器细胞治疗原发性光感受器疾病的临床试验获批 IND 。
中枢神经系统适应症
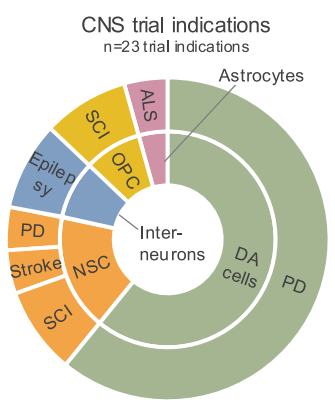
PD:帕金森病;SCI:脊髓损伤;Stroke:中风;Epilepsy:癫痫
ALS:渐冻症;DA cells:多巴胺细胞;NSCs:神经干细胞;Interneurons:中间神经元;OPCs:少突胶质前体细胞;
Astrocytes :星形胶质细胞
中枢神经系统疾病是 hPSC 衍生疗法的另一个重要应用领域,主要包括 PD、SCI 和癫痫等。在中枢神经系统 hPSC 试验中,针对帕金森病的研究较多。其他疾病如 SCI 等也有相关试验,但比例相对较低。
PD
2015年,中国启动了首个 hESC 衍生的多巴胺能祖细胞治疗 PD 的临床试验。此后,澳大利亚于 2016 年开展使用孤雌干细胞的试验,日本、美国、瑞典、韩国等也相继开展不同产品的临床试验,且部分试验显示出良好的安全性和部分患者的症状改善。当前,国内也有较多企业PD治疗领域布局了相关研发管线,如中盛溯源、睿健医药、跃赛生物以及士泽生物等。BlueRock Therapeutics 于 2021 年启动了hESC衍生的中脑多巴胺神经元产品进行给药治疗的试验,在I期试验中表现出良好的耐受性,24个月内未出现与药物相关的严重不良事件,该公司计划于2025年上半年启动名为 exPDite-2 的 III 期注册性临床试验成为在 hPSC 治疗 PD 领域进展最快的企业。
SCI
Geron 公司于2010年开发的用于治疗胸段SCI 的 hESC 衍生的少突胶质前体细胞产品 GRN - OPC1 是首个进入临床试验的 hPSC 产品,前期试验显示其安全性良好,但因细胞剂量低等原因未使患者显著改善。后续该技术被Asterias Biotherapeutics收购,并于2015年作为AST-OPC1在另一项针对颈椎SCI患者的I/II期剂量递增试验中启动,试验显示部分患者的神经功能恢复。此外,日本 Keio 大学和韩国 S.Biomedics 也开展了相关临床试验。
癫痫
2022年,Neurona Therapeutics 启动了首个 hESC 衍生的抑制性GABA能中间神经元产品 NRTX-1001 的临床试验,用于治疗药物难治性局灶性癫痫,取得积极疗效,且已扩大试验范围。
其他中枢神经系统适应症
2018 年以色列 KadimaStem 开展 hESC 衍生的星形胶质细胞治疗肌萎缩侧索硬化症的试验;2021 年斯坦福大学开展治疗缺血性皮质下中风的试验;2024年加州大学欧文分校开发了用于治疗亨廷顿舞蹈病的神经干细胞产品,已获 FDA 批准但尚未开始临床试验。
心脏疾病
目前,人们正在对患有心肌梗死和慢性心力衰竭的患者进行使用多种细胞类型的细胞替代疗法测试。心肌梗死后,多达 10 亿个心肌细胞会丢失,并被无收缩功能的瘢痕组织替代,这一过程可能会继发进展为慢性心力衰竭。为此,多个实验室正在开发 hPSC 衍生的心肌细胞,以改善心脏收缩功能。
2013年,Philippe Menasche 团队首次将 hESC 衍生的心肌细胞祖细胞移植到心梗患者的心脏表面,显示出良好的耐受性和部分患者的心脏功能改善。此后,多个团队开发了心肌细胞片、球体和悬浮液等不同形式的产品,如 Osaka University 的 hiPSC 心肌细胞片和 Heartseed 的 HS-001,部分试验显示心脏功能改善等迹象。
糖尿病
1 型糖尿病是由于胰腺内分泌胰岛中产生胰岛素的 β 细胞受到自身免疫介导的破坏而引发的疾病。鉴于其发病早且会带来严重的健康后果,自 20 世纪 70 年代起,人们就开始探索使用尸体来源的胰岛进行移植作为一种治疗选择。
2014年,Viacyte 启动了首个 hESC 衍生的胰腺内胚层细胞(PEC-01)的临床试验,用于治疗1 型糖尿病。早期试验因设备设计问题导致移植细胞存活率低,后续的改进设计试验结果还未公布。2021 年福泰制药启动了非封装的由hESC衍生的细胞 VX - 880 治疗PD的试验,其 I/II 期临床试验显示出胰岛细胞植入的迹象,部分患者实现了胰岛素独立。2024年 11 月,福泰制药宣布将最初的 I/II 期试验转为关键的 I/II/III 期试验,这使得 VX - 880 产品距离可能的上市又近了一步。
2023 年,中国天津市第一中心医院的邓宏魁团队采用了使用自体胰岛样细胞来避免移植物排斥的临床试验,报告显示第一名患者实现了胰岛素独立。
肝脏疾病
用于治疗急性肝衰竭的 PSC 衍生肝细胞是最难开发的产品之一。对于急性肝衰竭患者而言,在肝脏再生或获得可供移植的器官之前,给予 PSC 衍生的肝细胞作为桥接疗法,可能是一种挽救生命的干预措施。
目前基于多能干细胞(hPSC)的肝脏疾病治疗研究处于探索阶段,有两项临床试验正在进行当中。
中国中南大学湘雅医院正在对肝衰竭患者测试 hESC 衍生的肝细胞,计划招募 10 名患者;日本国立儿童健康与发展中心对 2 例患有尿素循环障碍的新生儿患者测试了 hESC - 肝细胞。不过,这两项试验的产品具体信息,如剂量、免疫抑制要求等均未披露,也尚未报告安全性或疗效数据 。
免疫和血液产品
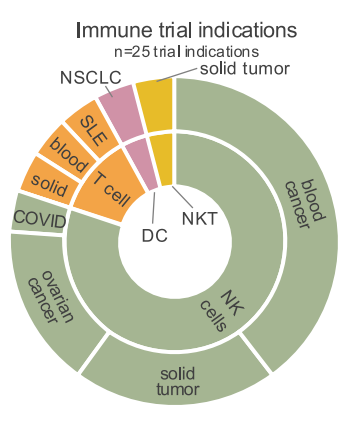
blood cancer:白血病;solid tumor:实体瘤;ovarian cancer:卵巢癌;COVID:新冠;SLE:系统性红斑狼疮;NSCLC:非小细胞肺癌;NK cells:自然杀伤细胞;T cell:T 细胞;DC:树突状细胞;NKT :自然杀伤 T 细胞
免疫和血液疾病是 hPSC 衍生疗法的另一个重要应用领域,主要针对卵巢癌、白血病、实体瘤等。CAR-T 疗法对难治性血液系统恶性肿瘤患者有显著疗效,但存在成本高、细胞质量不稳定和制造困难等问题。因此,开发同种异体现成的 hPSC 衍生的 NK 和 T 细胞产品成为研究方向。
NK细胞产品
Fate Therapeutics公司的FT500是首个hiPSC-NK 细胞产品,用于晚期实体瘤患者。后续产品如 FT516、FT538 等经过基因编辑,增强了细胞毒性和持久性,并引入了针对特定疾病的嵌合抗原受体,初步数据显示出安全性和耐受性,对部分白血病患者有较好的疗效。Century Therapeutics 公司的 hPSC 衍生 CAR19-iNK 细胞产品在试验中对复发或难治性 CD19 阳性 B 细胞恶性肿瘤患者显示出良好的安全性和一定的疗效。此外日本开发的抗 GPC3 NK 细胞产品在进行相关临床试验,但目前数据较少;国内生物科技公司中盛溯源的两条基于iPSC-NK的治疗管线,分别针对骨髓增生异常综合征以及预防异基因造血干细胞移植(allo-HSCT)后急性髓系白血病(AML)的复发,均已进入I/II期临床试验阶段,且前者是国内首个获批临床的 iPSC 来源 NK 细胞疗法;国内启函生物基于iPSC-NK的QN-019a 细胞注射液针对复发 / 难治性 B 急性淋巴细胞白血病,其临床试验申请于 2023 年 5 月 6 日获得受理。
T细胞产品
hiPSC衍生的 T 细胞产品开发更具挑战性,Fate Therapeutics 的 FT819 通过基因编辑消除了内源性 T 细胞受体,降低了移植物抗宿主病(GvHD)风险,并在复发/难治性 B 细胞淋巴瘤患者中显示出良好安全性。同时 FT819 在治疗SLE的试验中,已使首例患者达到无药物临床缓解为未来针对自身免疫性疾病的 B 细胞靶向治疗带来了希望。
树突状细胞产品
Geron 开发的用于治疗非小细胞肺癌的 hESC 衍生的树突状细胞产品 GRN - VAC02(现更名为 AST - VAC2)在试验中显示出良好的耐受性,并能诱导免疫反应。
血小板产品
iPSC 衍生血小板产品在血小板减少症治疗中展现出潜力,日本 CiRA 和 Megakaryon 公司分别成功在患者中测试了他们的 iPSC 衍生的血小板产品 iPLAT1 和 MEG-002,未观察到安全问题。
基质类产品
间充质基质细胞(MSCs)可来源于骨髓、脂肪组织和脐带血等,自 20 世纪 90 年代中期起就被用于临床试验。尽管已有超过1000项相关临床研究,但目前仅有用于治疗肛周瘘管性克罗恩病的 OSSM-001 获得 FDA 批准。
鉴于自体 MSCs 制造面临的挑战,hPSC 衍生的 MSCs成为研究热点。澳大利亚 Cynata Therapeutics 自 2017 年起测试 hPSC-MSC 产品用于治疗 GvHD、糖尿病足溃疡、骨关节炎等疾病。在治疗GvHD的 I 期试验中,CYP-001 产品在15名急性类固醇耐药性 GvHD 患者中显示出良好的耐受性和部分缓解。此外,韩国团队使用 hESC-MSC 治疗间质性膀胱炎,部分患者症状有所改善。美国 ImStem 公司开发的 hESC-MSC 产品正在进行多发性硬化症的临床试验。多个团队启动的针对 COVID-19 患者的 PSC-MSC 的临床试验,以及 Cynata Therapeutics 公司启动的用 CYP - 004 产品 治疗骨关节炎的 III 期临床试验,均未报告临床结果。国内,中盛溯源基于 iPSC-MSC 的 NCR100 注射液治疗膝骨关节炎这一管线已进入II期临床试验阶段,是国内首个获批临床的 iPSC 来源 MSC 细胞疗法;基于 iPSC-MSC 的 NCR101 注射液,于 2025 年 2 月 获批IND,用于治疗间质性肺病,成为全球首款基因修饰的 iPSC 来源 MSC 治疗产品。
随着hPSC临床试验的不断推进,其应用领域从最初主要集中在中枢神经系统和眼部疾病,逐渐拓展到多个领域,呈现出多元化发展的趋势。免疫和血细胞产品类别目前占所有接受治疗患者的 31%,且在糖尿病、癫痫、PD 和 AMD 等疾病治疗上出现可靠疗效数据。不过,该领域发展仍面临诸如II/III 期试验设计与 III 期试验设计、生产与技术、定价与市场上的挑战。为了使这种创新疗法能够从实验室走向临床应用,真正造福广大患者,必须有效应对这些挑战。只有克服了这些障碍,才能确保hPSC疗法顺利进入临床阶段,并为患者带来实际的治疗效果。因此,各方需要共同努力,推动技术进步,优化生产流程,制定合理的定价策略,以促进hPSC疗法的成功转化和广泛应用。