
近日,智利安第斯大学的科学家团队在Journal of Nanobiotechnology上发表了一项题为"Clinical‑grade extracellular vesicles derived from umbilical cord mesenchymal stromal cells: preclinical development and first‑in‑human intra‑articular validation as therapeutics for knee osteoarthritis"(脐带间充质基质细胞临床级外泌体:临床前开发和首次人类关节内验证作为膝骨关节炎的治疗)的研究。
在此次研究中,研究团队借助多种体外和体内实验,对脐带间充质基质细胞(UC - MSC)衍生的外泌体(sEV)开展了全面探究。研究内容涵盖其治疗膝骨关节炎的疗效、安全性,以及深入挖掘其发挥作用的潜在机制,致力于为膝骨关节炎的治疗开辟全新路径。
01 骨关节炎
骨关节炎(Osteoarthritis,简称OA),作为一种常见且呈进行性发展的多因素关节疾病,是引发慢性疼痛与导致残疾的关键因素之一。在众多受影响的关节中,膝盖堪称OA侵袭最为严重的部位,全球近4/5的OA病例都发生在膝关节。目前,针对膝骨关节炎,尚无能够延缓软骨退化或恢复关节软骨功能的治疗手段。现有治疗方案主要依靠多模式方法,目的在于控制疼痛和缓解关节僵硬症状 。
OA的显著特征包括慢性滑膜炎和软骨退化,越来越多的新证据显示,滑膜炎先于软骨退化出现。在滑膜组织中,巨噬细胞起着关键作用,促炎性M1亚型巨噬细胞释放的IL-1β、IL-6和TNF-α等细胞因子,会引发、维持和放大炎症;而具有抗炎表型的M2巨噬细胞分泌的IL-10,则对组织修复和炎症消退至关重要。在OA患者体内,滑膜炎表现为产生活性氧(ROS)的M1巨噬细胞数量增多,ROS会导致炎症、基质失调和软骨损伤,氧化应激还会诱导初级软骨细胞凋亡。因此,控制炎症和氧化应激成为OA治疗的关键策略。
间充质基质细胞(MSC)及其分泌的sEV在OA治疗方面展现出了潜力。MSC-sEV具有与细胞相似的组织再生能力,且作为无细胞治疗方案,安全性更高。在OA动物模型中,MSC-sEV疗法已显示出促进软骨再生、减缓OA进展的效果。而脐带(UC)来源的 MSC,因其具有较强的软骨形成能力、体外抑制T细胞增殖能力,以及相对较低的血管生成特性,被认为是治疗OA最具潜力的MSC来源。基于此,研究团队旨在开发一种基于UC-MSC衍生sEV的临床级疗法,并对其疗效和安全性进行评估。
02 研究数据
在此次科研探索中,研究团队旨在开发一种基于UC-MSC衍生sEV的临床级疗法,并深入探究其疗效与安全性。
为此,研究人员针对非cGMP条件下UC - MSC衍生的sEV开展了全方位的特征剖析。经研究发现,多个批次的sEV呈现出一致的miRNA和蛋白质谱,这一关键成果为后续实现标准化生产工艺奠定了坚实基础,极大地提升了UC- MSC衍生sEV疗法迈向临床应用的可行性。
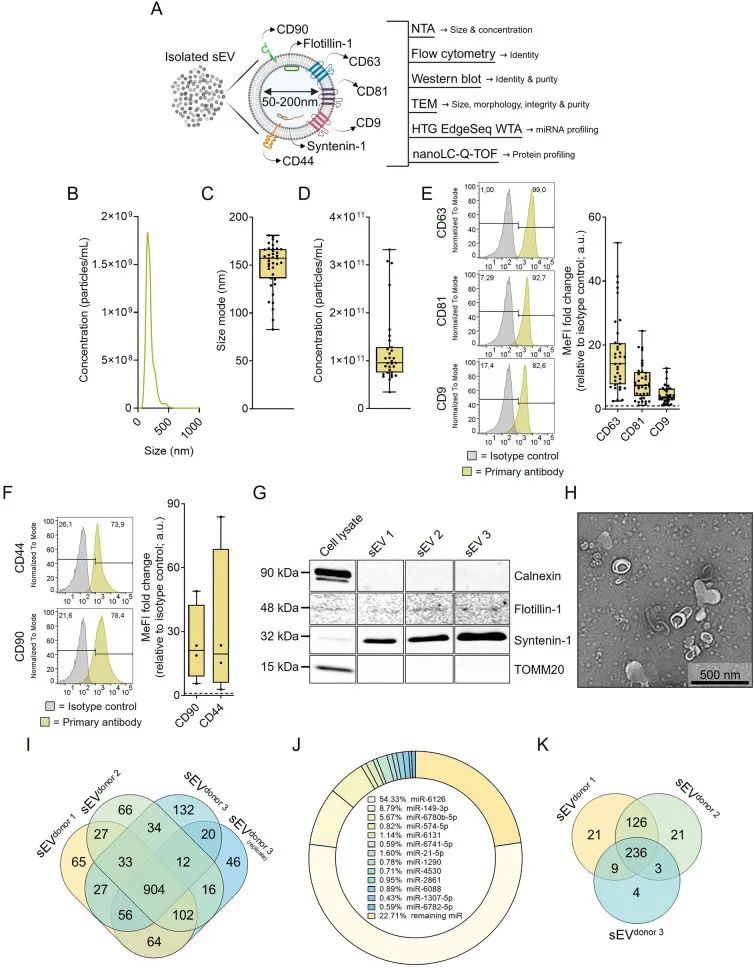
UC-MSC分泌具有独特和可复制的分子货物的sEV
体外实验
在体外实验中,sEV展现出了软骨保护活性。研究团队建立了极化的人单核细胞衍生的巨噬细胞(hmMΦs)模型,通过流式分析发现,sEV处理后的hmMΦs中,M1促炎标记物(CD86、HLA-DR)表达降低,M2抗炎标记物(CD206、CD163)表达升高;ELISA 检测显示,巨噬细胞分泌的抗炎因子IL-10增多,促炎因子IL-6、TNF-α和IL-1β减少。
不仅如此,在甲萘醌诱导的细胞毒性试验里,sEV能够切实有效地对软骨细胞起到保护作用,使得凋亡/死亡细胞的比例大幅降低。并且,基于LDH释放的细胞毒性试验结果表明,sEV对软骨细胞并未表现出明显的毒性。
这一系列体外实验结果充分证实了sEV在软骨保护方面具备积极且有效的作用。
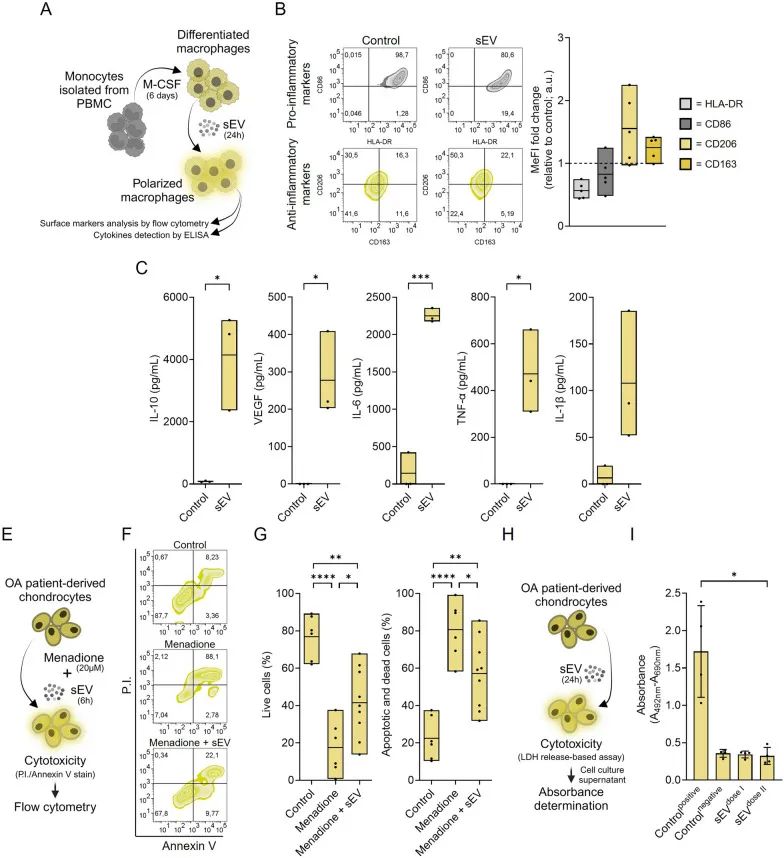
sEV驱动巨噬细胞极化并发挥抗氧化应激的软骨保护活性
小鼠实验
在小鼠实验阶段,研究团队构建了胶原酶诱导的骨关节炎(CIOA)小鼠模型,并进行关节内给药sEV的临床前实验。利用μCT图像分析发现,接受sEV治疗的小鼠膝关节骨密度(BMD)值和骨表面积与骨体积比(BS/BV)指数改善。同时,Safranin O/Fast green染色结果有力地证实了sEV对软骨的保护功效,其对应的组织学评分更低。
此外,对小鼠膝后淋巴结的检测结果显示,sEV具有抑制炎症的作用,能够对CD4+T细胞群进行有效调节,具体表现为减少促炎细胞数量,增加调节性 T 细胞(CD25+FOXP3+Treg 细胞)的比例。而生物分布测定结果表明,在注射DiR染色的sEV后,sEV能够长时间稳定地存在于小鼠的膝关节间隙内。
这些实验结果充分表明,sEV在改善小鼠骨关节炎症状、保护软骨以及调节免疫炎症反应等方面发挥着积极作用,为其后续应用于临床治疗骨关节炎提供了重要的实验依据 。
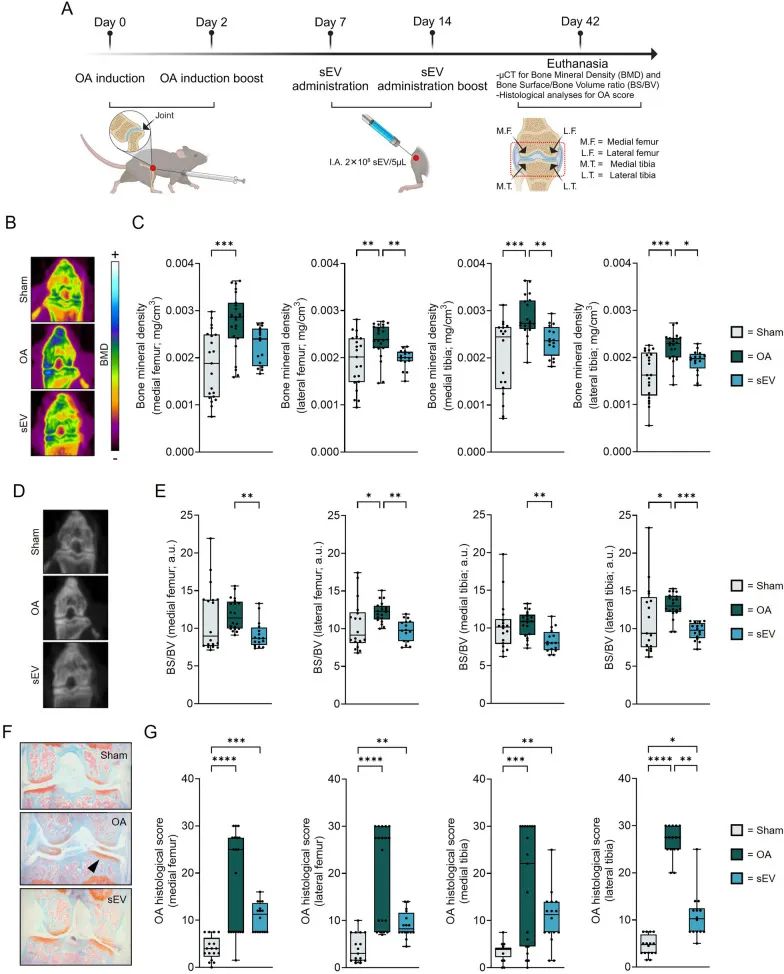
sEV降低骨关节炎的严重程度并促进小鼠体内模型的骨关节炎再生
人体临床试验
在首次人体临床试验中,研究团队将临床级UC-MSC-sEV注入膝骨关节炎患者关节内。结果显示,给药前和治疗1年后,患者的临床评分指数(WOMAC指数)降低,症状得到改善,且未观察到任何不良反应。第三方核磁共振检查通过SPAIR和WATSc序列评估发现,患者软骨无退化迹象,这证明了首次sEV人体关节内给药的初步安全性。
基于此,研究团队还设计了进一步的1期临床试验。在后续试验计划中,患者将分别接受低、中、高三种不同剂量(分别为 2±0.5E + 9 particles/3 mL,6±0.5E + 9 particles/3 mL,20±0.5E + 9 particles/3 mL)的sEV治疗,并对患者进行为期1年的随访观察。值得一提的是,这些前期试验结果在2019年开展的1/2期随机对照临床试验以及1期剂量递增临床试验中均得到了进一步验证。
1. sEV的摄取研究
为深入探究sEV的摄取机制,研究团队利用sEV示踪试剂对其进行标记,进而观察sEV进入骨关节炎相关细胞系的动态过程。当装载miRNA的sEV进入细胞后,通过实时荧光定量聚合酶链式反应(qPCR)对miRNA进行检测。实验结果证实,sEV不仅能够顺利进入细胞,而且携带了具有生物学功能的货物,为其发挥治疗作用奠定了基础。
2. 巨噬细胞极化和软骨细胞保护研究
研究过程中发现,MSC-sEV具有驱动巨噬细胞极化的独特功能。它能够显著增加具有抗炎活性的M2极化巨噬细胞的比例,同时促使M2巨噬细胞分泌更多的白细胞介素-10(IL-10)。IL-10对组织修复和炎症消退具有积极作用,进而在氧化应激环境中有效保护软骨细胞,为OA的治疗提供了新的作用途径。
3. 转录组学分析
借助转录组学技术,研究团队深入分析了MSC-sEV RNA中16种常见miRNAs的富集模式,并对其调控的蛋白质进行基因本体(GO)分析。通过这一研究,成功揭示了多个与巨噬细胞和炎症过程密切相关的生物学过程以及推定靶基因,为进一步理解MSC-sEV的作用机制提供了关键线索。
4. 动物模型实验
为了在体内环境下验证MSC-sEV的治疗效果,研究团队构建了关节炎小鼠模型,并通过关节内给予MSC-sEV的方式进行干预。实验过程中,利用微计算机断层扫描(μCT)技术,对关节区域的骨密度进行精确分析,以此评估关节再生和软骨修复情况。动物实验结果为MSC-sEV在OA治疗方面的潜在应用提供了有力的体内实验证据。
5. 免疫抑制活性和稳定性研究
在探究MSC-sEV的免疫抑制活性及稳定性方面,研究团队向小鼠关节腔内注射MSC-sEV,随后检测CD4+IL-17+细胞和CD4+IFN-γ+细胞水平,以此评估其免疫抑制活性。同时,通过sEV示踪分析,确定sEV在关节腔内的长期稳定性。实验结果表明,MSC-sEV能够在关节腔内长时间稳定存在,并持续发挥免疫抑制效应。
6. 存储稳定性验证
考虑到MSC-sEV未来商业化和临床应用的需求,研究团队对其进行了存储稳定性验证。通过一系列实验,确保MSC-sEV在存储过程中,其质量和活性能够得到有效维持,为其后续的实际应用提供了重要保障。
7. 首次人体1期临床研究设计
为了将MSC-sEV推向临床应用,研究团队精心设计了首次人体MSC-sEV给药的1期临床研究。在研究设计中,明确划分了不同剂量组,并确定了随访时间,为后续大规模临床试验的开展提供了科学、严谨的依据,推动了MSC-sEV从实验室研究向临床治疗的转化进程。
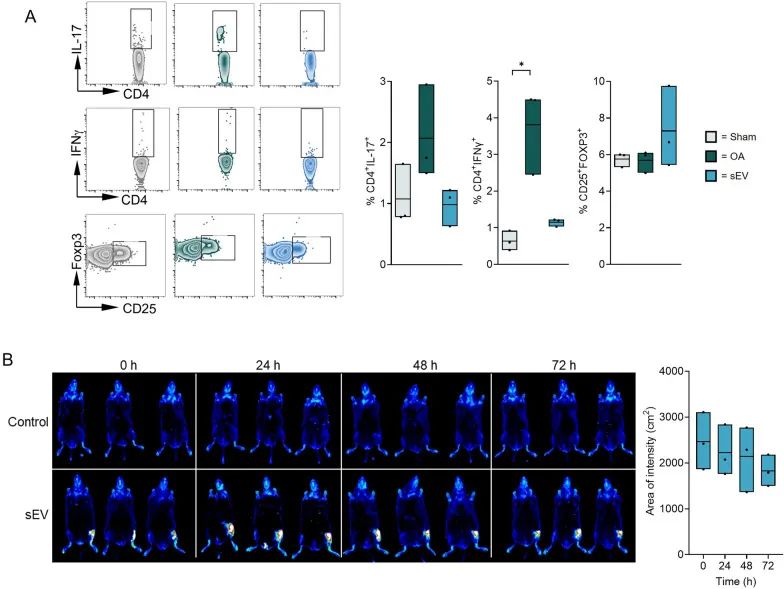
sEV在体内具有免疫抑制活性并维持在膝关节间隙内
通过多种体外和体内实验,该研究全面评估了UC-MSC衍生的sEV治疗膝骨关节炎的疗效、安全性及潜在作用机制。首次对临床级产品进行了人体关节内给药的安全性评估,确定了非cGMP条件下UC-MSC来源sEV的完整特征,以及标准化生产工艺的可行性。
研究充分证实了UC-MSC-sEV作为关节内给药疗法的再生和抗炎特性,以及良好的安全性。后续计划开展的不同剂量sEV治疗的1期临床研究,将进一步探索其治疗膝骨关节炎的最佳方案,为未来sEV在膝骨关节炎治疗领域的广泛应用奠定了坚实基础。