来源:成体干细胞国家地方实验室、国家药监局药审中心、上海市华兴健康产业合作促进中心
截至2023年9月30日,国内共有52家企业(不含子公司)的88款干细胞药物临床试验申请获得受理,其中8月份新增3款,9月新增4款。共有44家企业(不含子公司)的69款获准默许进入临床试验(临床试验默示许可),其中8月份新增3项,9月新增1项。88款受理干细胞药物中有10款已无法查到IND评审信息或评审暂停,10款正在评审中。
8月新增
新增受理
1、浙江金时代
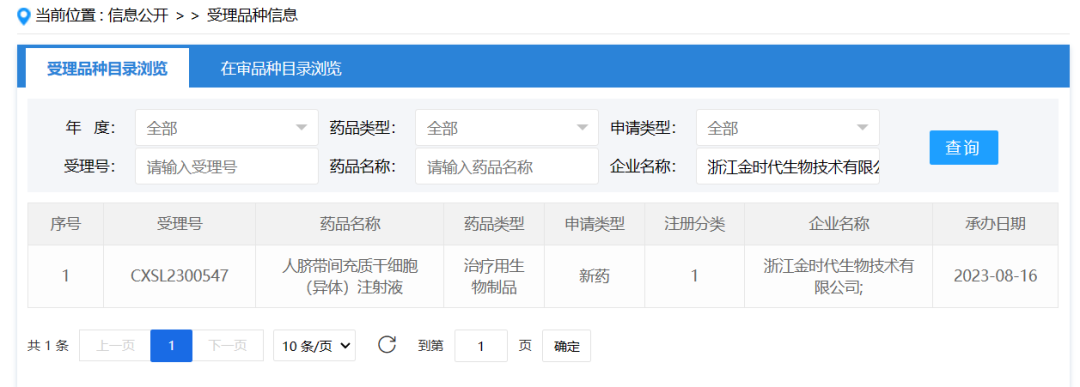
2023年8月16日,浙江金时代生物技术有限公司提交的“人脐带间充质干细胞(异体)注射液”临床试验申请获得受理(受理号:CXSL2300547),治疗急性移植物抗宿主病(GVHD)。
脐带间充质干细胞具有较强的免疫调节作用及造血恢复的促进作用,可望用于GVHD的治疗。在前期完成的临床前安全性有效性评价工作中,研究团队发现人脐带间充质干细胞(异体)注射液(临床拟用剂量)在对实验动物给予单次、多次给药后均无毒性反应,对中枢神经系统、呼吸系统、心血管系统均无毒副作用,无致瘤性、对改善GVHD动物模型的症状有着显著的疗效。
2、呈诺医学
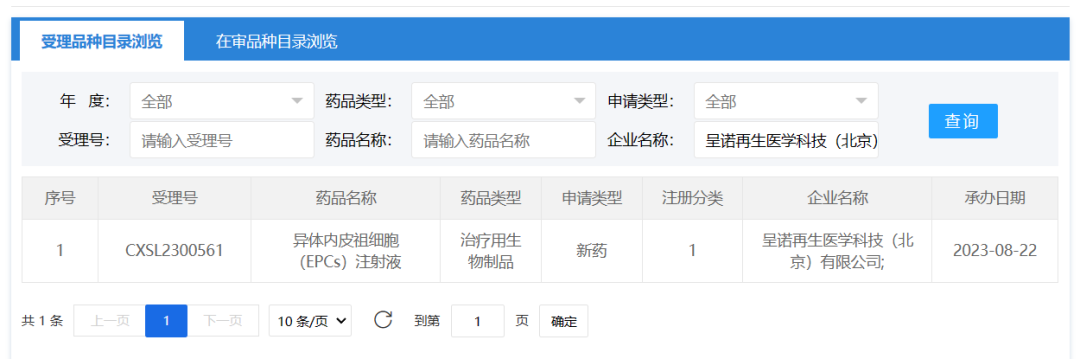
2023年8月22日,呈诺再生医学科技(北京)有限公司的异体内皮祖细胞(EPCs)注射液(ALF201)临床试验申请获得受理(CXSL2300561)。
ALF201是基于诱导多能干细胞(iPSC)定向诱导分化得到的异体内皮祖细胞(EPCs)注射液。2022年4月,呈诺医学研发的ALF201注射液(受理号:CXSL2200090)获得CDE的临床试验默示许可,成为全球首个获批临床的治疗急性缺血性脑卒中的iPSC衍生细胞候选产品,此次IND申报则为新适应症申报临床。
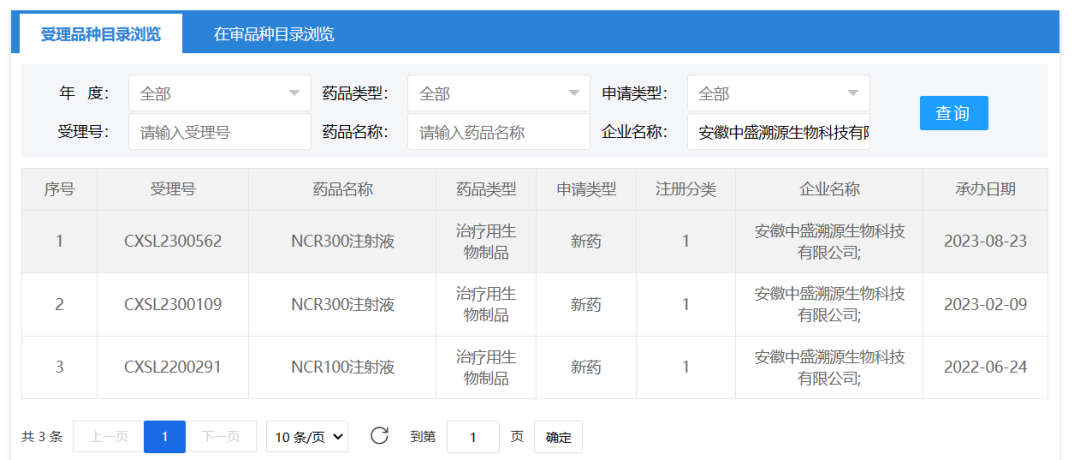
3、中盛溯源
2023年8月23日,安徽中盛溯源生物科技有限公司的“NCR300注射液”临床试验申请获得受理(CXSL2300562)。
“NCR300注射液”是中盛溯源通过优化生产工艺,在药品cGMP标准下工业化、大规模生产制备的iPSC来源的自然杀伤细胞(iNK)产品,可用于多种恶性肿瘤的临床治疗,提高细胞治疗的有效率和稳定性。今年4月20日,中盛溯源的“NCR300注射液”获批临床,拟开展针对骨髓增生异常综合征(MDS)的临床试验,成为国内首个获批临床的iPSC来源的iNK疗法。此次临床申报为新适应症申报。
新增默示许可
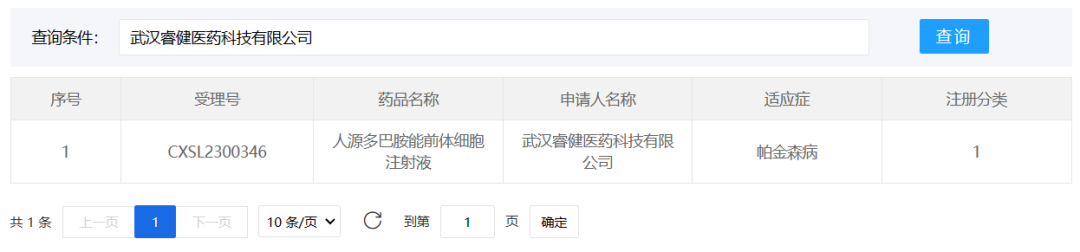
1、武汉睿健医药
2023年8月2日,武汉睿健医药科技有限公司的帕金森新药NouvNeu001(CXSL2300346)获得新药临床试验默示许可。这也是帕金森治疗领域中,全球首个进入临床阶段的基于化学诱导的通用型细胞治疗产品。
NouvNeu001是一种聚焦临床需求导向出发,利用化合物实现精细细胞功能改造,从而真正满足临床需求的通用型细胞治疗产品。NouvNeu001通过化合物调节实现高纯度神经元亚型分化,与体内原有神经元形成连接,并增强细胞分泌功能,进一步加强了移植细胞对原有病灶的改善,以达到综合性的治疗效果。
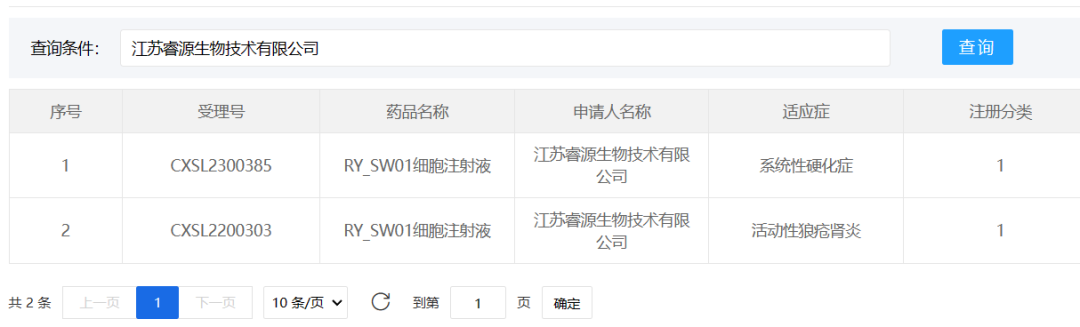
2、睿源生物
2023年8月22日,江苏睿源生物技术有限公司的生物制品1类新药“RY_SW01细胞注射液”获得新药临床试验默示许可(CXSL2300385),适应症为“系统性硬化症”。该适应症为罕见病,临床上尚无有效治疗药物。
“RY_SW01细胞注射液”属于间充质干细胞治疗产品。与传统疗法相比,间充质干细胞可以通过多种通路进行免疫调节,并且分泌细胞因子达到抗纤维化的作用;在安全性方面,不会引起类似免疫抑制剂带来的不良反应。间充质干细胞的这些特性为治疗硬皮病患者提供了一种新的策略,能够重塑患者免疫系统达到缓解痛苦和治疗疾病的作用。
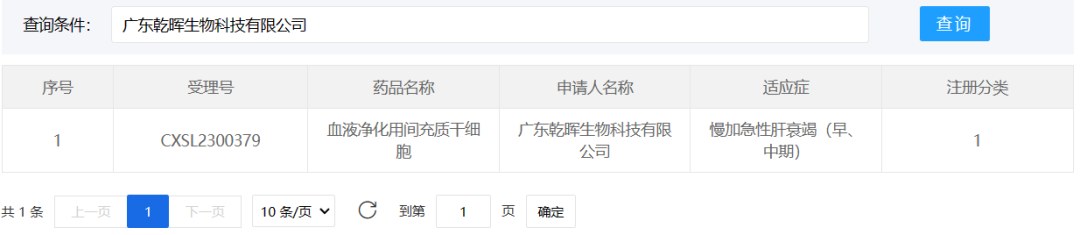
3、乾晖生物
2023年8月29日,广东乾晖生物科技有限公司的“血液净化用间充质干细胞”(受理号:CXSL230079)获得新药临床试验默示许可。这是国际首个适用于组合型生物人工肝治疗的血液净化用间充质干细胞产品,适应症为:慢加急性肝衰竭(早、中期)。
9月新增
新增受理
1、睿健医药(苏州)
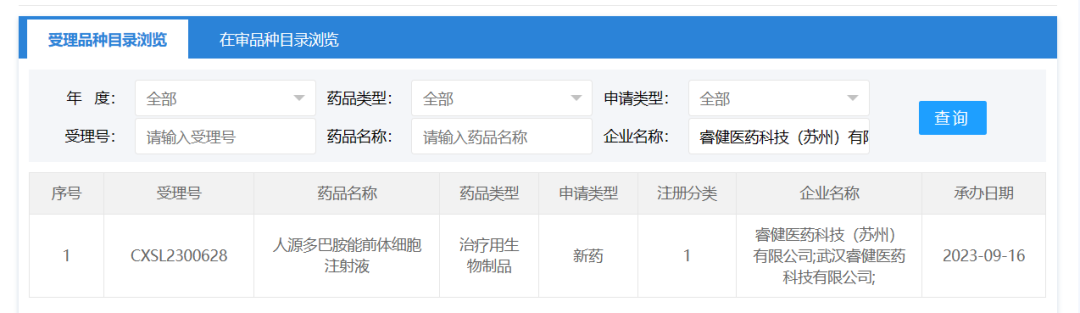
2023年9月16日,睿健医药科技(苏州)有限公司的 “人源多巴胺能前体细胞注射液”(iPSC衍生药物)的1项药物临床试验申请获受理(受理号为:CXSL2300628)。这是该款细胞注射液的第2种适应证获得受理,此前已获得默示许可用于帕金森病(受理号:CXSL2300346)。
NouvNeu001是睿健医药通过其自研的高效化学小分子诱导功能细胞再生技术开发的一款针对帕金森病的iPSC衍生药物,其将诱导多能干细胞作为“种子”,培养获得健康的多巴胺神经前体细胞,然后将之植入病灶部位,以此来弥补多巴胺能神经元的不足。这类前体细胞除了能够分泌多巴胺这类递质之外,还可以进一步分泌多种蛋白及小核酸来改善PD病灶,为移植到脑部的细胞发挥作用提供良好的“土壤”环境。
2、瑷格干细胞
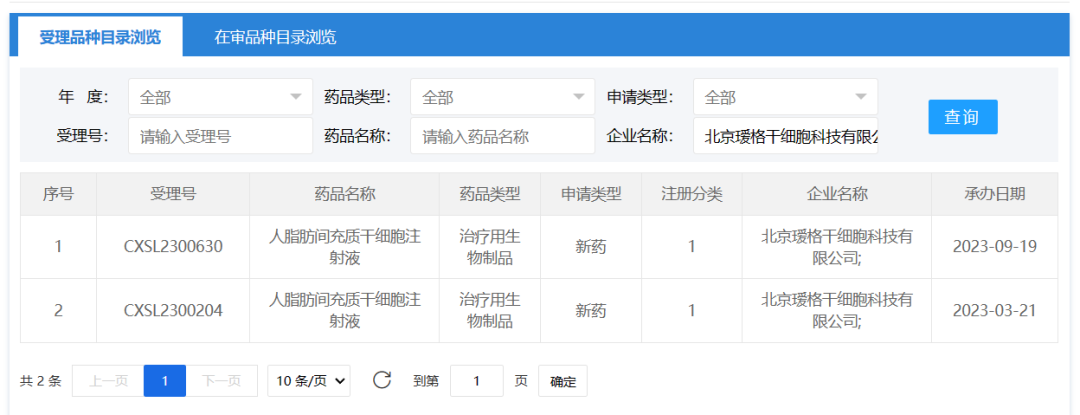
2023年9月19日,北京瑷格干细胞科技有限公司的 “人脂肪间充质干细胞注射液” 的1项药物临床试验申请获受理(受理号为:CXSL2300630)。这是该款干细胞注射液的第2种适应证获得受理,此前已获得默示许可用于系统性硬化症手部皮肤纤维化导致的手功能障碍(挛缩)(受理号:CXSL2300204)。
AG1001是瑷格干细胞以北京协和医院临床研究及专利技术为依托进行引进开发的干细胞治疗药物,开发过程采用严格的质控体系和制备技术,确保产品质量和生物学效能均一、稳定,临床前研究中获得了良好的安全性与有效性数据。AG1001在免疫调节、抗纤维化和促血管生成等方面的功能研究和临床试验探索,可以对抗系统性硬化症发病的三个病理轴,是一种极具潜力的治疗系统性硬化症的新型药物,临床应用潜力巨大。
3、艾尔普再生医学
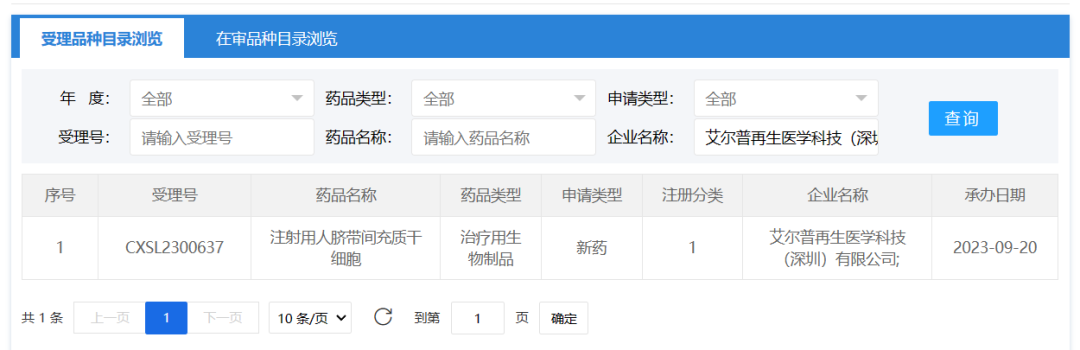
2023年9月20日,艾尔普再生医学科技(深圳)有限公司的 “注射用人脐带间充质干细胞” 的1项药物临床试验申请获受理(受理为:CXSL2300637),这是艾尔普的第1款间充质干细胞药物。此前艾尔普用于治疗严重慢性缺血性心力衰竭的人iPSC来源心肌细胞注射液(受理号:CXSL2200547)已获得默示许可。
4、茵冠生物
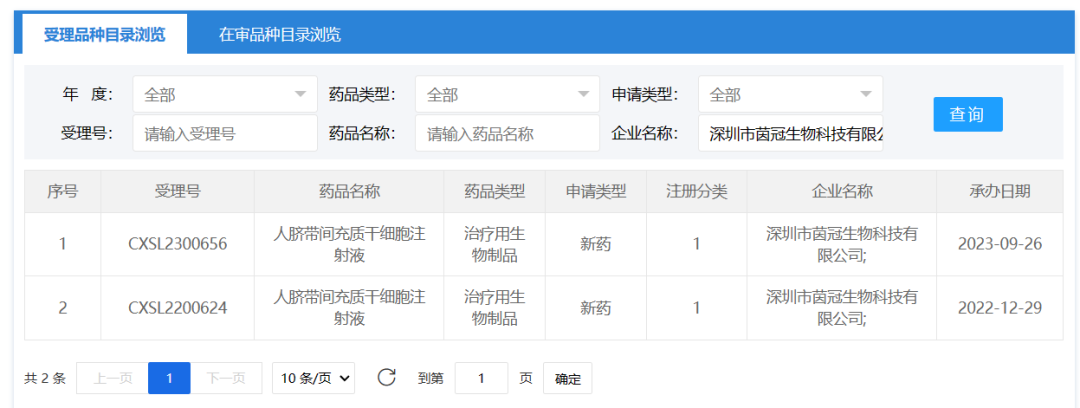
2023年9月26日,深圳市茵冠生物科技有限公司的 “人脐带间充质干细胞注射液” 的1项药物临床试验申请获受理(受理为:CXSL2300656),这是该款干细胞注射液的第2种适应证获得受理。目前药物相关信息暂未披露。此前已获默示许可用于急性缺血性脑卒中(受理号:CXSL2200624)。
新增默示许可
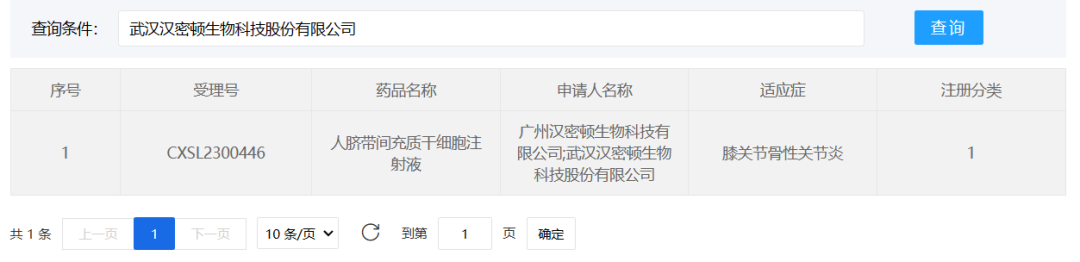
汉密顿生物
2023年9月27日,武汉汉密顿生物科技股份有限公司的“人脐带间充质干细胞注射液”(受理号:CXSL2300446)获得新药临床试验默示许可,适应证为膝关节骨性关节炎。这是该干细胞注射液的第1种适应证。