
来源:药闻窗
基因编辑有望治愈先天性疾病
随着人类基因组测序的完成、高效基因编辑技术的出现,针对基因水平的准疾病治疗逐渐走入大众的视野。基因编辑主要指利用基因工程手段对核酸序列DNA或RNA进行修饰,从而实现靶基因的定向改变,如基因插入、删除和置换等,最终获得所需要的新性状。
基因编辑治疗为解决困扰人类已久的先天疾病带来希望。由于许多先天疾病是由遗传基因异常导致的,因此长久以来,人类无法根治这一类型的疾病。基因编辑可以深入病源,带来治愈的希望。
01
基因编辑给先天性疾病带来希望
基因是决定生物表征的重要因素。一般将基因宽泛理解为存储生物遗传信息的载体。基因的存在使生物能够保留优势表征,是高级生物出现的基础。但是基因的遗传也伴随着大量的不确定性,不确定性来自于生物活动的随机性,不确定性带来了进化的可能性,同时也带来了疾病风险。对于大部分有性繁殖生物来说,基因一半来自父亲一半来自母亲,因此后代可能因为基因的纯合或杂合导致父辈中未曾出现过的疾病。
在人类以往的历史中,基因疾病往往难以治愈。由于基因深藏于人类身体最深处,难以从源头解决问题,通常需要长期服药以控制疾病进展,疾病负担较重。同时,许多基因疾病属于罕见病,治疗方案十分有限,导致较高的药物价格和较低的可及性,属于未被满足的医疗需求。
随着基因编辑工具的不断进步,基因编辑疗法也进入了发展的快车道。TALEN、ZFN,以及几乎革新了整个基因编辑领域的CRISPR-Cas系统使基因编辑疗法变得触手可及。2020年,来自加州大学伯克利分校的Jennifer Doudna教授和普朗克研究所的Emmanuelle Charpentier因在CRISPR领域的突出贡献获得了诺贝尔化学奖。与此同时,J. Doudna教授作为共同创始人成立的Intellia Therapeutics,E. Charpentier作为共同创始人成立的CRISPR Therapeutics已成长为基因编辑治疗领域的领军者,两家公司均已有管线进入临床阶段,有望在不久的未来,为困扰人类已久的基因疾病治疗带来曙光。同时,基于基因编辑技术,方兴未艾的细胞治疗也有望迎来跨越式的发展。
02
DNA缺陷伴随一生且可能影响后代
DNA通过蛋白控制影响着身体的活动和表征。DNA转化为蛋白质的过程分为两大步,第一步:DNA转化为mRNA,这一步骤称为转录(transcription),发生在细胞核内;第二步:mRNA 转化为蛋白质,这一步骤称为转译(translation),发生在细胞质中。mRNA是DNA转化为蛋白质的中间体,这也是它名称的由来,即信使RNA(messenger RNA)。
通俗来讲,DNA类似于底稿,DNA发生的改变会一直存在于体内,由此细胞分裂新产生的细胞也会继承这些改变,因此DNA的改变有很大概率会伴随一生,其中性细胞中DNA的变化甚至能够遗传至下一代。同时部分DNA片段会影响mRNA产生的速率与表达量。mRNA类似于说明书,能够指导自身细胞生产出特定的蛋白。蛋白则是最终生产得到的工具,对生物个体的各项指标直接产生作用。mRNA或蛋白的变化不会被继承或遗传。这一条转录转译链被称为生物学“中心法则”(The Central Dogma)。
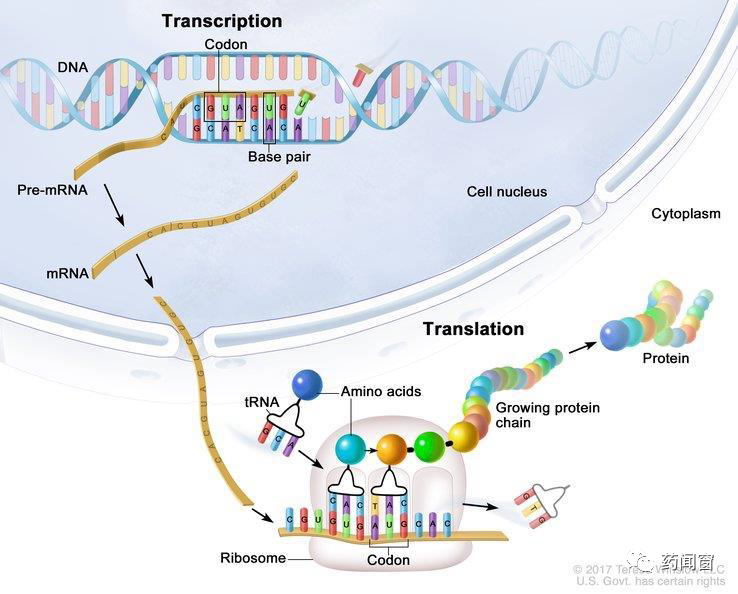 图1 中心法则:DNA-mRNA-蛋白转化过程
图1 中心法则:DNA-mRNA-蛋白转化过程
03
DNA与基因疾病和遗传性疾病
根据美国国家癌症研究院的定义,遗传遗传性疾病(hereditary syndrome)通常指部分或完全由具有遗传性的基因或染色体异常导致的疾病。根据美国国家人类基因研究院的定义,基因疾病(genetic disorder)指完全或部分由于DNA序列异常导致的疾病。遗传性疾病和基因疾病虽然不完全相同,但包含了很多重叠的病症。
DNA作为人类遗传物质的存储载体,深藏在细胞核中。一方面受到细胞结构和人体免疫机制的层层保护,不易发生改变;但另一方面,在出现基因异常时,现有的医学技术也难以提供有效的治疗方案。同时,DNA异常通常会伴随患者一生,且有很大几率遗传至后代。因此,患者疾病负担大,且缺乏有效的治疗手段。
除此之外,许多罕见病是由基因缺陷造成的。大部分具有缺陷的基因,会导致基因的携带者难以生存。由于基因是遗传信息载体,因此在长时间的自然选择中,这类基因难以被继承,所以许多基因疾病/遗传疾病都属于未被满足的医疗需求。
04
基因编辑的作用原理
基因编辑工具使人类拥有了定向改变DNA 或RNA 的能力。通过插入、删除、替代特定位点的核苷酸,我们能够改变基因表达,进而长久地影响蛋白序列或结构。援引发表在Yale Journal of Biology and Medicine 上的文章“Genome Editing: Past, Present, and Future”的内容,历史上,人类不断探索能够改变基因的方式。在20 世纪时,人类曾通过化学疗法、放射疗法改变肿瘤细胞的DNA,扰乱肿瘤细胞的生命活动,以此消灭肿瘤。但这2 种方法造成的基因变化是随机的,且难以精准定位。随着科学技术的发展,科学家们发明了3 种重要的基因编辑工具:锌指(ZFN)、TALEN、CRISPR。现代基因编辑工具的出现不仅大大加速了科学研究,同时也给许多基因疾病的治疗带来的可能性。
精准定位是基因编辑的重要能力,是实现定向编辑的第一步。靶向特定目标序列,而不是在DNA任意位置随意更改,使基因编辑成为可控的工具,并且规避不受控的基因突变带来的风险。不受控制的基因突变或不够精准的基因修改,常常会带来无法预测的肿瘤、免疫疾病等恶性病症。
在精确定位的基础上,一个好的基因编辑工具还应该能够识别并定位到任意的设定序列。这样基因编辑才能够广泛应用于不同的基因疾病。
许多基因疾病是由DNA 的错误表达或过度表达引起的。通过基因敲除或抑制,便能达到较好的治疗效果。因此,仅仅依靠基因编辑工具进行定位,同时引入可控的酶在这一位点进行切割,便能大大缓解乃至治愈这类疾病。目前,大部分体内基因编辑疗法便是利用这一机理,对致病基因进行定向敲除,达到治疗目的。
随着生物技术的发展,科学家们已经开始了基因敲入的研发。相较于基因敲除,基因敲入更为复杂,往往需要基因编辑工具以及基因插入技术(例如病毒载体插入技术)共同完成,因此目前的进展落后于基因敲除疗法。但基因敲入带来了更多治愈疾病的可能性,尤其对于部分由基因过少或缺失表达引起的疾病。
05
基因编辑具有永久有效的潜力
虽然名称相似,但基因编辑(gene editing)与基因治疗(gene therapy)有着本质的不同。
基因编辑,通过对基因进行改造,纠正错误的基因。由于这一改变发生在原本的基因组中,因此,就算细胞发生了分裂,这一改变也会被继承。因此,基因编辑通常被认为具有永久纠正致病基因的潜力。更进一步,若这一改变发生在性细胞中,则这一改变将可能被后代继承。
基因治疗,则是通过递送额外的基因进入细胞,使得细胞能够额外表达上述基因,但并不改变此前已经存在的基因。新的基因也不会被整合进入原本的基因组中,因此,在细胞发生分裂后,这一改变也不会被继承。理论上来讲,相较于基因编辑,基因治疗的持久性稍差。
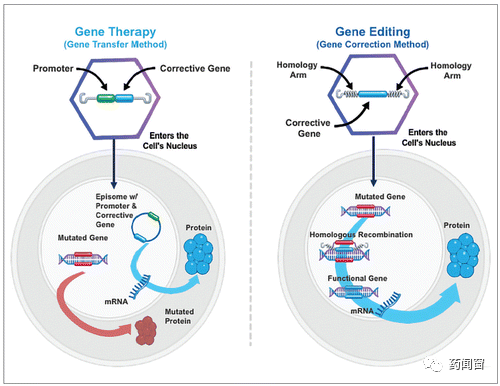 图2 基因治疗 vs. 基因编辑治疗
图2 基因治疗 vs. 基因编辑治疗
06
基因编辑工具:CRISPR
人类对生物医药的探索不断,所掌握的药物种类不断丰富。从小分子化学药到生物药、核酸干扰药物(RNAi)、基因治疗、基因编辑治疗。随着药物种类的丰富,治疗能够触达的靶点也更为广阔:小分子化学药和生物药(单抗、双抗等)作用于蛋白质,RNAi 作用于RNA,基因治疗和基因编辑作用于DNA。
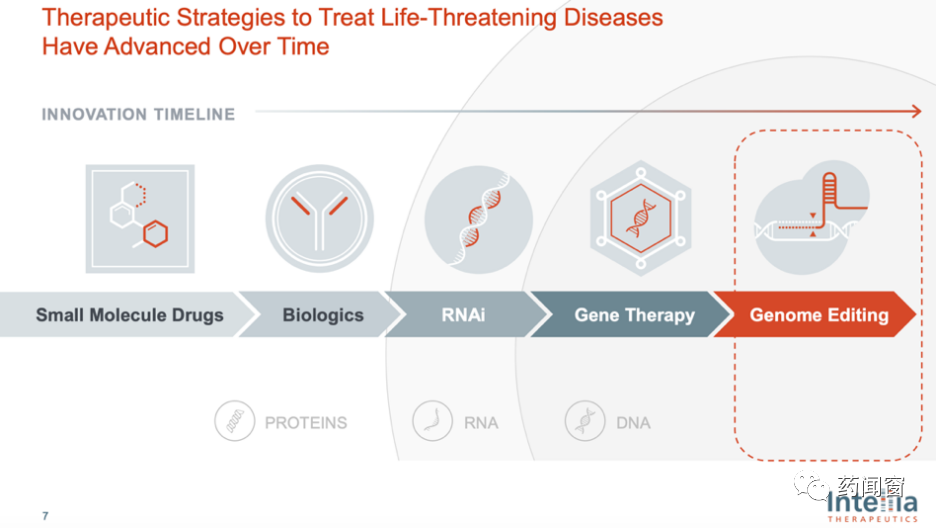 图3 药物迭代史
图3 药物迭代史
TALEN,Transcription Activation-Like Effector Nucleases,是一种限制性酶。通过工程化改造后,具有切割DNA链特定位点的能力。TALEN主要分为2个功能域:DNA结合域(DNA binding domain)和DNA切割域(DNA cleavage domain)。
DNA结合域负责识别位点,引导切割酶至正确的编辑位点。DNA结合域的核心部分由相连的数个重复的氨基酸序列片段组(tandem amino acid repeats)组成,每个氨基酸片段组由33-34个单位的氨基酸构成,每个片段组对应DNA链上的1个碱基。每个氨基酸片段组的序列基本相同,除了第12-13个氨基酸不同,这两个位点被称为repeat-variable diresidue(RVD)。正因为这2个位置的氨基酸可变,因此通过控制这两个位置的氨基酸,基因编辑工具可以靶向DNA的4种不同碱基。每个片段组对应1个DNA碱基,数个前后衔接的片段组便可以靶向特定的DNA序列。
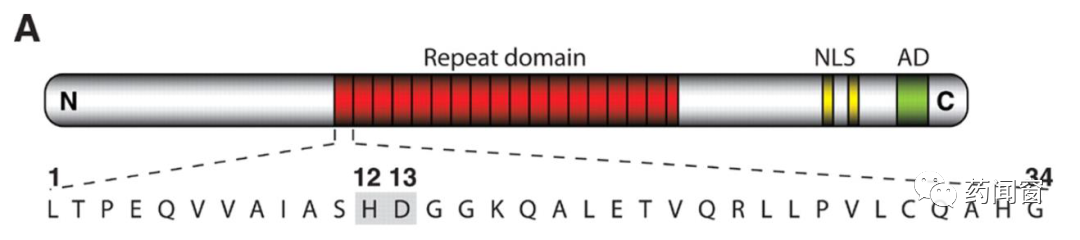 图4 TAL Effector结构
图4 TAL Effector结构
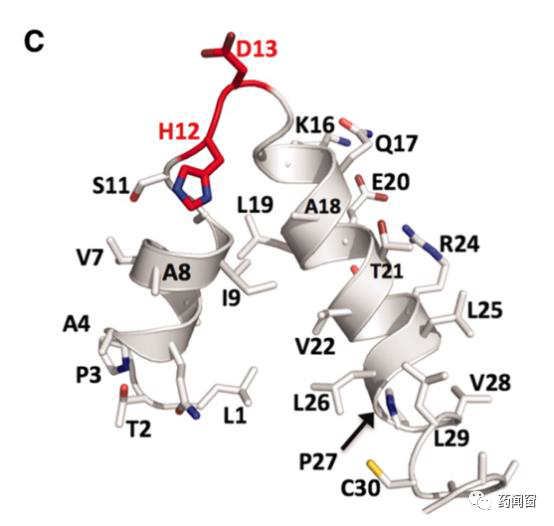 图5 TAL Effector中一个repeat单位的蛋白三维结构示意图
图5 TAL Effector中一个repeat单位的蛋白三维结构示意图
DNA切割域在DNA结合域的帮助下,来到选定的位点进行切割。FokI内切酶是常见的切割工具。FokI 需要形成二倍体(dimer)来进行切割,因此TALEN通常由2条分别靶向DNA正链和反链的TALEN组成。TALEN将会切割2个靶向序列之间的位置。
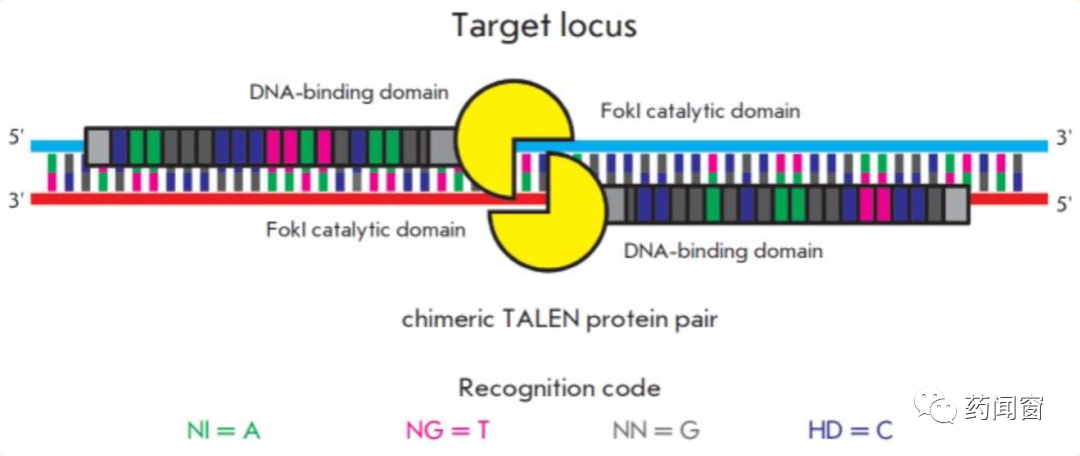
图6 TAL Effector + FokI 二倍体
优势:
相较于ZFN,TALEN 靶向性更强,毒性较小(可能由于更准确的亲和导致)。
相较于ZFN,TALEN 不需要选择或定向进化,节省构造时间和成本。
相较于CRISPR,TALEN 不需要PAM 序列,理论上可选择的靶点更多。(但由于基因组中通常有多个潜在有效靶点,因此这一优势并不突出)。
劣势:
TALEN 结构较大,对递送提出了较高的要求。常见的病毒载体慢病毒(lentivirus)和腺相关病毒(AAV)难以运送这么大分子量的“货物”。目前科学家尝试以mRNA 的方式递送TALEN。
相较于CRISPR,TALEN 的制造流程相对复杂,成本较高。
相较于CRISPR,TALEN 的结构设计更为复杂。CRISPR 仅需重新构建gRNA 序列即可,而TALEN 需要考虑DNA 结合等因素。
CRISPR,Clustered Regularly Interspaced Short Palindromic Repeat,来源于细菌和其他微生物。
CRISPR 是细菌对抗病毒入侵的重要免疫机制,通过识别病毒基因序列,CRISPR 可以引导细菌内的生物机制对病毒基因序列进行摧毁和消灭,使病毒无法在细菌体内复制繁殖。
CRISPR是细菌基因组内的一片由短小DNA重复片段(回文)和spacer组成的区域。当某一种类病毒首次入侵时,病毒的部分基因片段会被整合存储在spacer中。经过转录(transcription)和各类蛋白的处理,带有病毒基因序列的CRISPR RNA(crRNA)形成,并引导分子切割机制对病毒基因进行切割。由于序列直接由病毒基因复制得到,因此crRNA与病毒基因的识别匹配程度非常高。
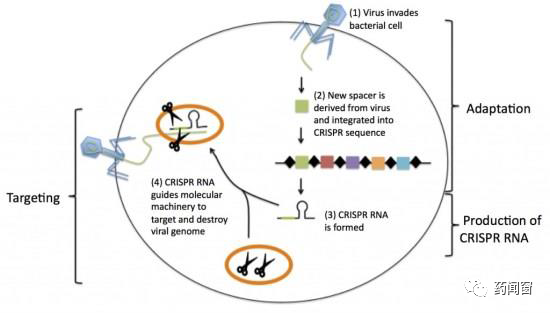 图7 CRISPR 对抗病毒入侵机制
图7 CRISPR 对抗病毒入侵机制
CRISPR机制赋予了一个可靠的定位机制。在此基础上,一个完整的基因编辑工具还需要切割机制来对DNA 链进行切割。自然界中, 细菌的CRISPR免疫系统中包含的Cas家族基因(CRISPR-associated gene)便可以完成这一工作。Cas家族中包含多个不同的基因,拥有不同的功能或切割方式。
gRNA负责是CRISPR基因编辑的定位器。gRNA由crRNA和tracrRNA组成。crRNA携带有目标序列的RNA。crRNA和tracrRNA形成互补结构,科学家进一步研究发现,将crRNA和tracrRNA相连,并不影响整体机制的运作和活性。形成的单链gRNA(sgRNA)更为便捷。
Cas蛋白是负责切割DNA链的剪刀。Cas蛋白中,HNH域负责切割靶序列,RuvC域负责切割靶序列的互补链。切割位点与PAM序列相关。
此前CRISPR无法在哺乳动物细胞中发挥作用,原因是CRISPR-Cas系统无法穿过核膜进入细胞核。张锋团队在Cas 蛋白序列上添加了NLS(Nuclear localization sequence),NLS与入核载体相互作用,将Cas运载进入细胞核。
优势:
易于操作,简单便捷。
设计空间大,基本可以靶向任何靶点序列。
成本较低。
gRNA和Cas可以拆分递送。
劣势:
CRISPR的gRNA长度有限制,可能导致脱靶事件出现。
07
基因编辑治疗路径
基因编辑治疗根据基因编辑发生的场景主要分为2 条路径:体内(in vivo)和体外(ex vivo)。
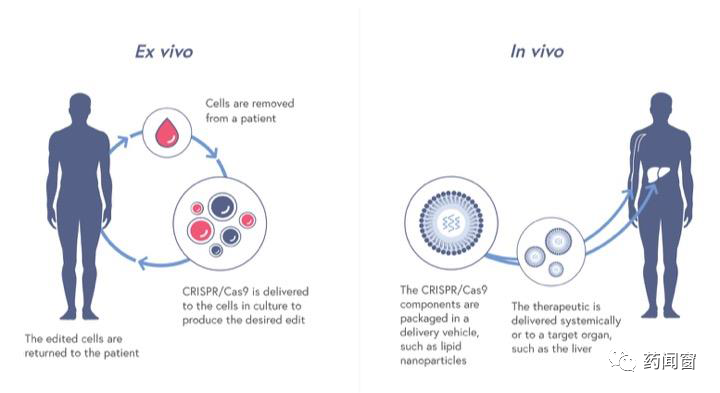 图8 基因编辑治疗的2 条路径
图8 基因编辑治疗的2 条路径
体内基因编辑指将基因编辑工具递送进入患者体内,基因编辑发生在人体内。而顾名思义,体外基因编辑治疗中,基因编辑发生在体外(例如实验室等),通常需要提取患者细胞,在实验室中对患者细胞进行基因编辑,再将经工程化改造后的细胞回输至患者体内。整体流程类似于现有的CART细胞治疗。
两条路径各有优势,也各有不同的技术挑战。目前来看,采用体外基因编辑路径的公司相对更多。
这一选择可能是由于体内基因编辑对安全性的要求更高、技术难度更大。
体内基因编辑相较于体外基因编辑难度更高,而体内基因编辑中,基因敲入比基因敲除难度更高。因此,基因敲入所需掌握的技术复杂,要求高。因此目前进展也落后于其他路径。
从步骤上来看,基因敲除通过CRISPR系统gRNA和Cas在特定位点剪切DNA链,造成双链断裂(DSB),使靶点基因无法正常表达。根据Intellia的设计思路,基因敲入同样需要CRISPR系统先剪切DNA双链,再通过病毒载体(Intellia目前使用的是腺相关病毒AAV作为载体)在剪切位置插入缺失的基因。
因此基因敲入由2个部分组成。第一部分由LNP作为递送系统包裹用于定位的gRNA和编码Cas(用于切割)的mRNA,在设定位点进行切割。第二部分由病毒载体作为递送系统,将患者缺失的基因递送进入细胞核,并整合进患者基因中。
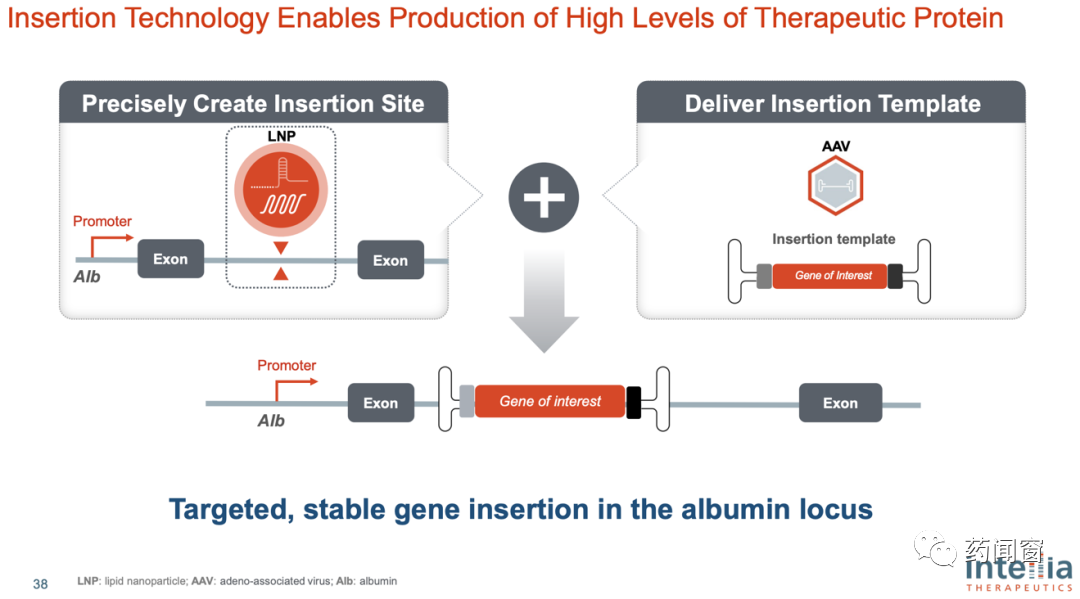
图9 体内基因编辑-敲入治疗实现路径
相较于体内编辑,体外基因编辑是竞争者较多的细分赛道。主要原因是体外基因编辑可以通过质量控制保证基因编辑的质量,将不达标的细胞去除,从安全性的角度来看更为可靠,也更容易被监管机构所接受。
从某个角度来说,体外基因编辑是利用基因编辑工具赋能细胞治疗。目前的细胞治疗,受制于细胞免疫机制,以自体型为主。排异反应来自多个人体免疫机制,例如T 细胞和NK 细胞(与HLA 基因相关)。同时,若输注的治疗细胞量较大的话,输注细胞可能会对人体细胞产生排异(与TCR 相关)(GvHD)。通过基因编辑,尽量干扰或阻断引起排异反应的信号通路。
Intellia 在此提供了一些可能的改进思路。例如:通过敲除治疗细胞的TCR 来避免移植物排斥宿主病(GvHD);通过基因敲入引入CAR 或TCR 来增强细胞对肿瘤的杀伤;敲除II 型HLA 基因来避免CD-4 介导的排异反应;敲除HLA-A 来避免CD-8 介导的排异反应;调整HLA-B 和HLA-C 来避免NK 细胞介导的排异反应。